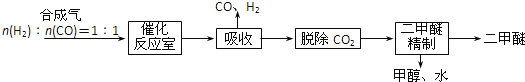
题目内容
【题目】某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量
请回答下列问题:
(1)该实验的目的是_________________
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g若要将所称取的样品恰好溶解,最多需要蒸馏水____________g,溶解样品所需的仪器是_____________________
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
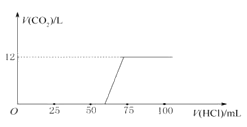
则13.3 g 该样品中未变质的NaOH的质量为____________;NaOH的变质程度为_________(用质量分数表示);与NaOH反应消耗的盐酸体积为________mL
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像,他们从实验中还发现了什么问题?_____________________,并由此得出了什么结论?_______________ ____________
【答案】(1)测定NaOH的变质程度
(2)61.3 烧杯玻璃棒量筒
(3)8.00g 33.3% 50.0
(4)NaOH被盐酸中和后继续滴加盐酸未立即产生气体 CO32-![]()
【解析】
试题分析:(1)根据题目叙述,该实验的目的是测定NaOH的变质程度;
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g利用极值法,若要将所称取的样品恰好溶解,最多需要蒸馏水xg,![]() 得到X=61.3g
得到X=61.3g
溶解样品所需的仪器是烧杯玻璃棒量筒(3)由图可知,生成二氧化碳为1.12L,则:

m(Na2CO3)=![]() =5.3g
=5.3g
故样品中氢氧化钠的质量=13.3g-5.3g=8g
根据![]() ,
,
生成5.3g碳酸钠需要氢氧化钠4g,NaOH的变质程度为![]() 33.3%
33.3%
(2)8g氢氧化钠的物质的量=![]() =0.2mol,则:
=0.2mol,则:
![]()
氢氧化钠消耗盐酸的体积=![]() =0.05L=50mL。
=0.05L=50mL。
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像从实验中还发现NaOH被盐酸中和后继续滴加盐酸未立即产生气体,说明![]() 、
、![]() 分步进行。
分步进行。

 阅读快车系列答案
阅读快车系列答案