题目内容
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
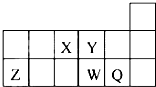

| A、含元素Z的盐溶液一定显酸性 | B、原子半径的大小顺序为:rX>rY>rZ>rW>rQ | C、1mol CaY2与CO2反应时,转移2mol电子 | D、NaXO2溶液中加入盐酸可观察到红棕色气体 |
分析:根据元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素,结合元素周期律的递变规律解答该题.
解答:解:由元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素.
A.含Al元素的盐可能为偏铝酸盐,溶液呈碱性,故A错误;
B.原子核外电子层数越多,半径越大,同一周期元素原子半径从左到右逐渐减小,则有:rZ>rW>rQ>rX>rY,故B错误;
C.CaO2中O元素化合价为-1价,1mol CaO2与CO2反应时,自身发生氧化还原反应,转移1mol电子,故C错误;
D.NaNO2溶液中加入盐酸,可发生氧化还原反应生成NO,进而被氧化生成二氧化氮气体,可观察到红棕色气体,故D正确.
故选D.
A.含Al元素的盐可能为偏铝酸盐,溶液呈碱性,故A错误;
B.原子核外电子层数越多,半径越大,同一周期元素原子半径从左到右逐渐减小,则有:rZ>rW>rQ>rX>rY,故B错误;
C.CaO2中O元素化合价为-1价,1mol CaO2与CO2反应时,自身发生氧化还原反应,转移1mol电子,故C错误;
D.NaNO2溶液中加入盐酸,可发生氧化还原反应生成NO,进而被氧化生成二氧化氮气体,可观察到红棕色气体,故D正确.
故选D.
点评:本题考查位置结构性质的相互关系及应用,为高频考点,题目难度中等,注意掌握元素周期表的结构和元素周期律的递变规律.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
则这三种元素的原子序数从大到小的排列顺序为( )
| 元素 | 熔点(℃) | 沸点(℃) | 与水作用 | 纯液体的导电性 |
| X | -183 | -162 | 不与水反应也不溶于水 | 不导电 |
| Y | -102 | 19 | 放热,形成的酸是弱酸 | 不导电 |
| Z | 680 | - | 剧烈反应生成H2,溶液呈碱性 | 导电 |
| A、X、Y、Z |
| B、Z、X、Y |
| C、Y、X、Z |
| D、Z、Y、X |
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )