题目内容
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)=4Na+O2↑+2H2O;后来盖· 吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:l
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
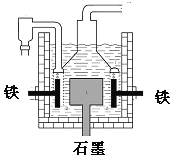
【答案】D
【解析】
试题分析:A.由4NaOH(熔)![]() 4Na+O2↑+2H2O可知,阳极氢氧根离子放电生成氧气和水,电极反应为4OH--4e-=2H2O+O2↑,故A错误;B.1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;C.由4NaOH(熔)
4Na+O2↑+2H2O可知,阳极氢氧根离子放电生成氧气和水,电极反应为4OH--4e-=2H2O+O2↑,故A错误;B.1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;C.由4NaOH(熔)![]() 4Na+O2↑+2H2O、3Fe+4NaOH
4Na+O2↑+2H2O、3Fe+4NaOH![]() Fe3O4+2H2↑十4Na↑可知,戴维法生成4molNa转移4mol电子,但盖吕萨克法生成4molNa转移8mol电子,则转移电子总数为1:2,故C错误;D.电解熔融氯化钠法制钠时,石墨极为阳极,氯离子放电,在阴极钠离子放电,发生2NaCl
Fe3O4+2H2↑十4Na↑可知,戴维法生成4molNa转移4mol电子,但盖吕萨克法生成4molNa转移8mol电子,则转移电子总数为1:2,故C错误;D.电解熔融氯化钠法制钠时,石墨极为阳极,氯离子放电,在阴极钠离子放电,发生2NaCl![]() 2Na+Cl2↑,如铁为阳极,则铁被氧化,故D正确;故选D。
2Na+Cl2↑,如铁为阳极,则铁被氧化,故D正确;故选D。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目

