题目内容
【题目】已知某物质X能发生如下转化:
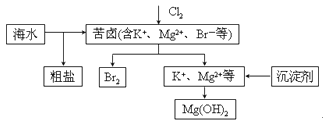
![]()
下列有关上述转化关系中物质及其反应的叙述错误的是( )
A.若X为![]() 或
或![]() ,则A为硝酸
,则A为硝酸
B.若X为![]() 或
或![]() ,则A为硫酸
,则A为硫酸
C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
【答案】D
【解析】
A. 若X为![]() 或
或![]() ,则Y为NO、Z为NO2,A为硝酸,A选项正确;
,则Y为NO、Z为NO2,A为硝酸,A选项正确;
B. 若X为![]() 或
或![]() ,则Y为SO2、Z为SO3,A为硫酸,B选项正确;
,则Y为SO2、Z为SO3,A为硫酸,B选项正确;
C. 若X为非金属单质或非金属氢化物,比如C或CH4,则Y为CO、Z为CO2,A为H2CO3,它不能与金属铜反应生成CO;若X为S或N2或它们的氢化物,则A能与金属铜反应生成SO2(NO),C选项正确;
D. 若X为钠,反应①和②一定为氧化还原反应,反应③是Na2O2与H2O的反应,为氧化还原反应,D选项错误。
故选D。

【题目】实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
实验 | 装置 | 试剂x | 操作及现象 |
Ⅰ |
| 1 mol·L1 CuCl2溶液 | 加入2mL CuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
Ⅱ | 1 mol·L1 CuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
已知:Ⅰ.Cu2+![]() [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
Ⅱ. Cu+![]() [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液)![]() [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_______,反应的离子方程式为_______。
(2)对实验 Ⅰ 产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
① 假设a不合理,实验证据是_______;
② 实验表明假设b合理,实验I反应的离子方程式有_____、H+ + HSO3- = SO2↑+H2O。
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_______(补全实验操作及现象)。

(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ: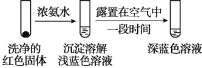
证实红色沉淀中含有Cu+的实验证据是_______;
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:_______。
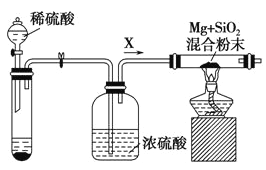
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

| 苯 | 溴 | 溴苯 |
密度 | | | |
沸点 | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入![]() 液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、![]() 的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是___![]() 填入正确选项前的字母
填入正确选项前的字母![]() ;
;
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是________。
a.25 mL ![]()
![]()
![]()