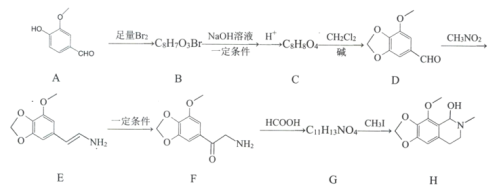
题目内容
【题目】20℃,每100g水仅能溶解0.148gCa(OH)2。CaCO3在水中达到溶解平衡时,其Ksp为8.0×10-9(溶液密度近似为1g/cm3)。
(1)计算20℃时Ca(OH)2饱和溶液中的c(OH-);_________
(2)在10 mL Ca(OH)2饱和溶液中加入10mL0.10mol/L的K2CO3溶液,忽略溶液体积变化,通过计算判断是否生成CaCO3沉淀_________,并求此时溶液中c(Ca2+)。__________
【答案】0.04mol/L 有CaCO3沉淀生成 c(Ca2+)=2.0×10-7 mol/L
【解析】
(1)20℃,每100g水能溶解0.148gCa(OH)2,此时得到的Ca(OH)2溶液密度近似为1g/cm3,则Ca(OH)2的溶解度为s=0.148g/100g水,则水溶液中饱和溶液的物质的量浓度为c=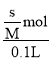 =
=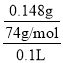 =0.02mol/L,因此Ca(OH)2的溶度积常数为Ksp[Ca(OH)2]=c(Ca2+)·c2(OH)= c ·(2c)2=4c3=3.2×105,则20℃时,Ca(OH)2饱和溶液中的c(OH)=0.04mol/L,
=0.02mol/L,因此Ca(OH)2的溶度积常数为Ksp[Ca(OH)2]=c(Ca2+)·c2(OH)= c ·(2c)2=4c3=3.2×105,则20℃时,Ca(OH)2饱和溶液中的c(OH)=0.04mol/L,
答案为:0.04mol/L;
(2)由(1)可知,Ca(OH)2饱和溶液中的c(OH)=0.04mol/L,则c(Ca2+)=![]() =0.02 mol/L,
=0.02 mol/L,
10mLCa(OH)2饱和溶液中n(Ca2+)=0.02 mol/L×0.01L=0.0002 mol,10mL0.1mol/LK2CO3中n(CO32)=0.1 mol/L×0.01L=0.001 mol,向10mLCa(OH)2饱和溶液中加入10mL0.1mol/LK2CO3溶液,混合后溶液体积为20ml,c(Ca2+)=![]() =0.01 mol/L,c(CO32)=
=0.01 mol/L,c(CO32)=![]() =0.05 mol/L,c(Ca2+)×c(CO32)=0.01 mol/L×0.05 mol/L=5×10-4>
=0.05 mol/L,c(Ca2+)×c(CO32)=0.01 mol/L×0.05 mol/L=5×10-4>![]() =8.0×10-9,则反应生成碳酸钙沉淀,根据反应 Ca2+(aq)+ CO32 (aq)CaCO3(s),0.0002 mol Ca2+消耗CO320.0002 mol,剩余n(CO32)=0.001 mol-0.0002 mol=0.0008mol,c(CO32)=
=8.0×10-9,则反应生成碳酸钙沉淀,根据反应 Ca2+(aq)+ CO32 (aq)CaCO3(s),0.0002 mol Ca2+消耗CO320.0002 mol,剩余n(CO32)=0.001 mol-0.0002 mol=0.0008mol,c(CO32)=![]() =0.04 mol/L,
=0.04 mol/L,
c(Ca2+)=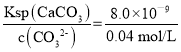 =2.0×10-7 mol/L,
=2.0×10-7 mol/L,
答案为:有CaCO3沉淀生成;c(Ca2+)=2.0×10-7 mol/L。