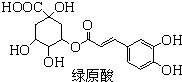
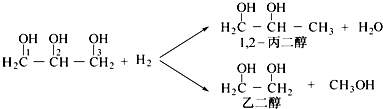
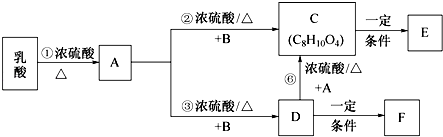
题目内容
【题目】Fe 和 Fe2O3 的混合物共 27.2g,加入 200mL 稀 H2SO4,在标准状况下收集到 2.24LH2,Fe和 Fe2O3 均无剩余。为中和过量的 H2SO4,并使 Fe 元素全部转化为 Fe(OH)2 沉淀,消耗了 400mL 3mol/L 的 NaOH 溶液,则该 H2SO4 的物质的量浓度为
A. 3mol/L B. 2.25mol/L C. 2mol/L D. 0.5mol/L
【答案】A
【解析】Fe和Fe2O3的混合物与稀H2SO4反应,Fe和Fe2O3均无剩余,且有H2生成,说明反应生成FeSO4,再加入NaOH溶液,使FeSO4全部转化为Fe(OH)2沉淀,反应后溶液成分为Na2SO4,根据硫酸根守恒,则n(H2SO4)=n(Na2SO4),根据钠离子守恒,则n(Na2SO4)=![]() n(NaOH),则有:n(H2SO4)=n(Na2SO4)=
n(NaOH),则有:n(H2SO4)=n(Na2SO4)=![]() n(NaOH)=
n(NaOH)=![]() ×3mol/L×0.4L=0.6mol,故c(H2SO4)=
×3mol/L×0.4L=0.6mol,故c(H2SO4)=![]() =3mol/L,故选A。
=3mol/L,故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目