��Ŀ����
����Ŀ����ƹ�ҵ�����������������ж���ˮ�����뾭���ϸ�����ſ����ŷţ�ij�ֺ�A���ӣ������ӣ���ˮ���ŷ�ǰ�Ĵ����������£�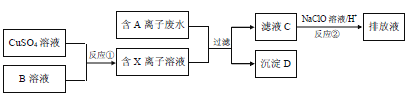
��֪��9.0g����D�����������պ���8.0g��ɫ���壬���ɵ�����ͨ����������ʯ��ˮʱ������10.0g��ɫ���������õ��Ļ�������ȥ������ʣ�������ܶ�Ϊ1.25gL��1������E 1.12L��
��1��E�Ľṹʽ
��2������D�Ļ�ѧʽ
��3��д������D�����������շ����Ļ�ѧ����ʽ
��4����ҺC�л���������A���ӣ�ͨ����Ӧ�ڣ��ɽ���ת��Ϊ�Ի����������ʣ��������ӷ���ʽ��ʾ��ԭ��
��5����Ӧ��Ϊ�Ƶ�ij��Ԫ�صĵͼ�X���ӣ��Դ�������ԭ��Ӧ�ĽǶȷ������Ƿ������Na2SO3��Һ������B��Һ��˵������ �������ʵ�鷽��֤��Na2SO3��Һ�Ƿ����
���𰸡�
��1��N��N
��2��CuCN
��3��2CuCN+3O2![]() ?2CuO+N2+2CO2
?2CuO+N2+2CO2
��4��2CN ��+5ClO��+2H+=5C1��+2CO2��+N2��+H2O
��5�����ԣ���ΪNa2SO3�л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+��ȡ����Na2SO3��Һ���ȼ���BaCl2��Һ���ټ�������ϡ���ᣬ�۲������������У�˵��Na2SO3��Һ�����ʣ���ȡ����Na2SO3��Һ���ȼ�������ϡ���ᣬ�ټ���BaCl2��Һ���۲������������У�˵��Na2SO3��Һ�����ʣ�
��������9.0g����D�����������պ���8.0g��ɫ���壬��ɫ����ӦΪCuO�����ɵ�����ͨ����������ʯ��ˮʱ������10.0g��ɫ��������ɫ����ΪCaCO3 �� �����ʵ���Ϊ![]() =0.1mol��̼Ԫ������Ϊ0.1mol��12g/mol=1.2g�����������ʵ���Ϊ
=0.1mol��̼Ԫ������Ϊ0.1mol��12g/mol=1.2g�����������ʵ���Ϊ![]() =0.05mol��CuO�����ʵ���Ϊ
=0.05mol��CuO�����ʵ���Ϊ![]() =0.1mol��C��N��CuԪ��������Ϊ1.2g+1.4g+0.1mol��64g/mol=9g�����ڳ���D����������D��Cu��C��N����Ԫ����ɣ�����ԭ�����ʵ���֮��Ϊ0.1mol��0.1mol��0.05mol��2=1��1��1����D�Ļ�ѧʽΪCuCN��A����ΪCN�����ӡ�XΪCu+���ӣ�BӦΪ���л�ԭ�Ե����ʣ�
=0.1mol��C��N��CuԪ��������Ϊ1.2g+1.4g+0.1mol��64g/mol=9g�����ڳ���D����������D��Cu��C��N����Ԫ����ɣ�����ԭ�����ʵ���֮��Ϊ0.1mol��0.1mol��0.05mol��2=1��1��1����D�Ļ�ѧʽΪCuCN��A����ΪCN�����ӡ�XΪCu+���ӣ�BӦΪ���л�ԭ�Ե����ʣ�
��1��E�ǵ����������ĽṹʽΪ��N��N�����Դ��ǣ�N��N��
��2�������Ϸ�����֪����D�Ļ�ѧʽ�ǣ�CuCN�����Դ��ǣ�CuCN��
��3������D�����������շ����Ļ�ѧ����ʽ��2CuCN+3O2![]() 2CuO+N2+2CO2 �� ���Դ��ǣ�2CuCN+3O2
2CuO+N2+2CO2 �� ���Դ��ǣ�2CuCN+3O2![]() 2CuO+N2+2CO2��
2CuO+N2+2CO2��
��4��CN��������NaClO����������ת��Ϊ�Ի����������ʣ�Ӧ�����ɵ�����������̼�������Ȼ�����ˮ���ɣ���Ӧ���ӷ���ʽΪ��2CN��+5ClO��+2H+=5Cl��+N2��+2CO2��+H2O��
���Դ��ǣ�2CN ��+5ClO��+2H+=5C1��+2CO2��+N2��+H2O��
��5��Na2SO3���л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+���ӣ�������Na2SO3��Һ������B��Һ��
Na2SO3��Һ����Ϊ����Na2SO4 �� ����Na2SO3��Һ�Ƿ���ʵķ���Ϊ��ȡ����Na2SO3��Һ���ȼ���BaCl2��Һ���ټ�������ϡ���ᣬ�۲������������У�˵��Na2SO3��Һ�����ʣ���ȡ����Na2SO3��Һ���ȼ�������ϡ���ᣬ�ټ���BaCl2��Һ���۲������������У�˵��Na2SO3��Һ�����ʣ�
���Դ��ǣ����ԣ���ΪNa2SO3�л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+��
ȡ����Na2SO3��Һ���ȼ���BaCl2��Һ���ټ�������ϡ���ᣬ�۲������������У�˵��Na2SO3��Һ�����ʣ���ȡ����Na2SO3��Һ���ȼ�������ϡ���ᣬ�ټ���BaCl2��Һ���۲������������У�˵��Na2SO3��Һ�����ʣ�

����Ŀ����ˮ��������M�ķֽ�����Ӱ�����ؽ����о�������ͬ�¶��£�M�����ʵ���Ũ�ȣ�molL��1����ʱ�䣨min���仯���й�ʵ�����ݼ���������˵������ȷ���ǣ�������
ʱ�� | 0 | 5 | 10 | 15 | 20 | 25 |
��pH=2�� | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
��pH=4�� | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
��pH=4�� | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
����pH=4����Ca2+�� | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
A.��0��20 min�ڣ�����M�ķֽ�����Ϊ0.015 molL��1min��1
B.ˮ������Խǿ��M�ķֽ�����Խ��
C.��0��20 min�ڣ�����M�ķֽ�ٷ��ʱȢ��
D.����Ca2+���ڣ�����M�ķֽ����ʱȢ��
����Ŀ��C��N��O��Al��Si��Cu�dz���������Ԫ�أ�
��1��Siλ��Ԫ�����ڱ������ڵ��壮
��2��Nԭ�ӵ�ԭ�ӽṹʾ��ͼΪ��Cu�ĵͼ����������ɫΪ ��
��3���á�����������գ�
ԭ�Ӱ뾶 | �縺�� | �۵� | �е� |
AlSi | NO | ���ʯ����� | CH4SiH4 |
��4�������£�����ȥ��������Ĥ��Al��CuƬ����ŨHNO3�����ԭ��أ�ͼ1�������ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ2��ʾ����Ӧ�������к���ɫ��������� 
0��t1ʱ��ԭ��صĸ�����AlƬ����ʱ�������ĵ缫��Ӧʽ�� �� ��Һ�е�H+�����ƶ���t1ʱ��ԭ����е��������������ı䣬��ԭ���� ��



