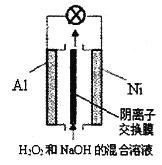
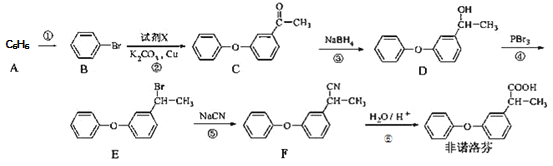
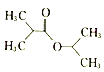
题目内容
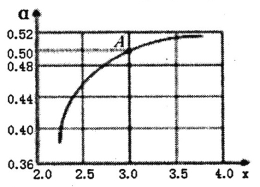
【题目】常温下,体积都为V0mL、浓度都为0.1mol·L-1的MC1、NaR、MR三种盐溶液,加入蒸馏水稀释至VmL,溶液的pH与1g(V/V0)的关系如图所示。下列说法不正确的是

A. 曲线X代表NaR溶液,其中c(OH-)=c(H+)+c(HR)
B. 曲线Y中任何两点,水的电离程度都相同
C. 将等体积等物质的量浓度的MC1和NaR溶液混合后,c(M+)=c(R-)
D. 常温下,HR的电离常数Ka≈1×10-5
【答案】B
【解析】
从图分析,三种盐分别酸性、碱性和中性,所以MOH为弱碱、HR为弱酸,则MC1为强酸弱碱盐,NaR为强碱弱酸盐,MR为弱酸弱碱盐。即X为NaR,Y为MR,Z为MC1。
A. 曲线X代表NaR溶液,为强碱弱酸盐,其中存在质子守恒,c(OH-)=c(H+)+c(HR),故正确;
B. 曲线Y为MR,弱酸弱碱盐,溶液呈中性,说明弱酸根离子和弱碱的阳离子水解程度相同,但促进水电离,向溶液中加水稀释,水解程度增大,即水的电离程度增加,故错误;
C. 将等体积等物质的量浓度的MC1和NaR溶液混合后M+、R-的水解程度相同,则有c(M+)=c(R-)。故正确;
D. 0.1mol·L-1NaR的pH=9,水解平衡常数约为![]() ,根据电离平衡常数和水解平衡常数的关系KW=Ka×Kh分析,常温下,HR的电离常数Ka≈1×10-5,故正确。
,根据电离平衡常数和水解平衡常数的关系KW=Ka×Kh分析,常温下,HR的电离常数Ka≈1×10-5,故正确。
故选B。

练习册系列答案
相关题目