题目内容
【题目】碳是地球上组成生命的最基本元素之一,可以sp3 、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有__________种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:

试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
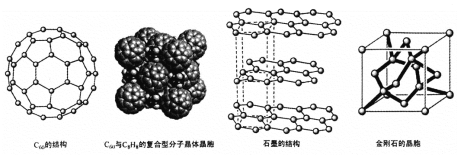
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为 cm。
【答案】(1)6;![]() ;(2)平面三角形;sp2;(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中阳离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;(4)C8H8·C60;(5)4;
;(2)平面三角形;sp2;(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中阳离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;(4)C8H8·C60;(5)4;![]() ρNAr;
ρNAr;
【解析】
试题分析:(1)碳原子核外有6个电子,原子核外没有运动状态相同的电子,即有6种运动状态不同的电子,碳原子价电子排布式为2s22p2,根据泡利原理与洪特规,价电子排布图为![]() ,故答案为:6;
,故答案为:6;![]() ;
;
(2)光气的分子式为COCl2,其分子中C原子形成3个σ键,没有孤对电子,空间结构为平面三角形,杂化轨道数目为3,C原子采取sp2杂化,故答案为:平面三角形;sp2;
(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中阳离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解,故答案为:碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中阳离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;
(4)晶胞中C60数目为8×![]() +6×
+6×![]() =4,立方烷分子填充在原C60晶体的分子间空隙中,晶胞中立方烷数目为4,则化学式为C8H8·C60,故答案为:C8H8·C60;
=4,立方烷分子填充在原C60晶体的分子间空隙中,晶胞中立方烷数目为4,则化学式为C8H8·C60,故答案为:C8H8·C60;
(5)由图可知石墨的晶胞结构为 ,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为 ,则
,则![]() =r×sin60°,可得a=
=r×sin60°,可得a=![]() r,则底面面积为(
r,则底面面积为(![]() r)2×Sin60°,晶胞中C原子数目为1+2×
r)2×Sin60°,晶胞中C原子数目为1+2×![]() +8×
+8×![]() +4×
+4×![]() =4,晶胞质量为
=4,晶胞质量为![]() g,则:ρg.cm-3=
g,则:ρg.cm-3=![]() g÷[(
g÷[(![]() r)2×Sin60°×2d]cm3,整理可得d=
r)2×Sin60°×2d]cm3,整理可得d=![]() ρNAr2,故答案为:4;
ρNAr2,故答案为:4;![]() ρNAr。
ρNAr。

【题目】将0.2molL-1的的KI溶液和0.05 molL-1Fe2(SO4)3溶液等体枳混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-![]() 2 Fe2++I2的组合是
2 Fe2++I2的组合是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和③ C. ③和④ D. ①








