题目内容
【题目】铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为_______________________。
(2)以H2、O2、熔融Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2。
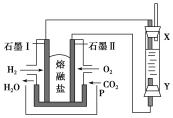
①石墨Ⅰ电极上的电极反应式为________________________________。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是________(填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作电解液
C.阴极发生的反应是2H2O+2e-===H2↑+2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为______________________________,该反应的化学方程式为________________________________________。
【答案】(1)2Fe3++Cu===2Fe2++Cu2+
(2)①H2-2e-+CO![]() ===CO2+H2O ②BC ③白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O===4Fe(OH)3
===CO2+H2O ②BC ③白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【解析】(2)①书写石墨Ⅰ电极反应式时,要注意负极产物H+与熔融碳酸盐中的CO![]() 反应生成H2O和CO2。②A项,只需Y端的阳极用铁作电极,错误;B项,电解质溶液可以选用NaOH、Na2SO4溶液等,正确;C项,水电离出的H+在阴极上放电,正确;D项,若选用FeCl2溶液作电解液,白色沉淀可在阴极上产生,错误。③Fe(OH)2具有强还原性,暴露在空气中易被氧气氧化成Fe(OH)3。
反应生成H2O和CO2。②A项,只需Y端的阳极用铁作电极,错误;B项,电解质溶液可以选用NaOH、Na2SO4溶液等,正确;C项,水电离出的H+在阴极上放电,正确;D项,若选用FeCl2溶液作电解液,白色沉淀可在阴极上产生,错误。③Fe(OH)2具有强还原性,暴露在空气中易被氧气氧化成Fe(OH)3。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案