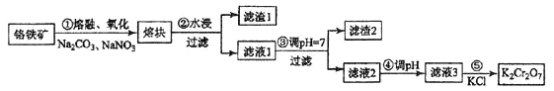
题目内容
【题目】以空气中的氮气为原料制备硝酸,合成线路如图(反应条件及部分反应物、生成物已略去):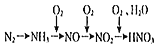 已知空气中含氮气的体积分数为78%,若用100 L(已折算成标准状况下)空气制备硝酸,则理论上可制得硝酸的量的计算式正确的是
已知空气中含氮气的体积分数为78%,若用100 L(已折算成标准状况下)空气制备硝酸,则理论上可制得硝酸的量的计算式正确的是
A.![]() B.
B.![]() mol
mol
C.![]() ×63 gD.2×100×78% L
×63 gD.2×100×78% L
【答案】C
【解析】
由N原子守恒可推得:N2~2HNO3,根据关系式计算,注意由于氮气为气体,硝酸为液体,二者体积之比不等于它们的物质的量之比。
氮气的物质的量n(N2)=(100 L×78%)÷22.4 L/mol=![]() mol,由N原子守恒可知存在:N2~2HNO3,故n(HNO3)=2n(N2)=2×
mol,由N原子守恒可知存在:N2~2HNO3,故n(HNO3)=2n(N2)=2×![]() mol,所以理论上可制得硝酸的质量m(HNO3)=
mol,所以理论上可制得硝酸的质量m(HNO3)=![]() ×63 g,由于氮气为气体,硝酸为液体,二者体积之比不等于它们的物质的量之比,故合理选项是C。
×63 g,由于氮气为气体,硝酸为液体,二者体积之比不等于它们的物质的量之比,故合理选项是C。

【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。