题目内容
【题目】下列气态氢化物最稳定的是
A. HF B. HCl C. HBr D. H2S
【答案】A
【解析】试题分析:非金属性越强,氢化物的稳定性越强,四种元素中非金属性最强的是F,则氢化物最稳定的是HF,答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 浓盐酸 | MnO2 | 产生黄绿色气体 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 酸化的FeCl2溶液 | H2O2溶液 | 溶液变成棕黄色,有气泡产生 |
D | Fe2(SO4)3溶液 | 铜粉 | 溶液变蓝色、有黑色固体产生 |

A. A B. B C. C D. D
【题目】以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氧化锌和金属锌。
Ⅰ.制取氧化锌主要工艺如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为l.0mol/L计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Zn2+ | 5.2 | 6.4 |
Fe2+ | 5.8 | 8.8 |
(1)为了加快反应,“酸溶”需要适当加热,但温度不宜太高,原因是_________。
(2)加入H2O2溶液发生反应的离子方程式_______。
(3)流程图中,为了降低溶液的酸度,调节pH范围为_______;若试剂X为Zn2(OH)2CO3,加入X除杂质的离子方程式为________。
(4)已知,室温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=3时,溶液中c(Fe3+)为______。从ZnCl2溶液中提取无水ZnCl2的方法是__________.
Ⅱ.制取金属锌采用碱溶解ZnO(s)+2NaOH (aq)+H2O=Na2[Zn(OH)4](aq),然后电解浸取液。
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是______。
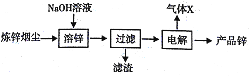
(6)以石墨作电极电解时,阳极产生的气体为______;阴极的电极反应为______。
