题目内容
18.工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:N2(g)+3H2(g)$\frac{\underline{\;一定条件下\;}}{\;}$2NH3(g)△H=-92.4kJ/mol,某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图1:①与实验Ⅰ比较,实验Ⅱ改变的条件为:使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图2画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图.
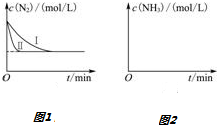
分析 ①该反应是一个反应前后气体体积减小、放热的可逆反应,催化剂只改变反应速率不影响平衡移动;
②正反应放热,升高温度平衡向逆反应方向移动,氨气的转化率减小.
解答 解:①与实验Ⅰ比较,实验Ⅱ达到平衡时间少,说明反应速率增大,但平衡不移动,应加入催化剂,而压强、温度都可使平衡移动,故答案为:使用催化剂;
②正反应放热,升高温度平衡向逆反应方向移动,氨气的转化率减小,则平衡浓度减小,图象为 ,
,
故答案为: .
.
点评 本题考查化学平衡影响因素,为高频考点,明确平衡移动原理及化学反应速率影响因素内涵是解本题关键,注意:催化剂只影响反应速率改变反应达到平衡时间而不影响平衡移动,为易错点.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
9.KCl与KNO3在不同温度的溶解度数据如下表.则下列说法正确的是( )
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| KCl | 30g | 33g | 35g | 38g | 41g |
| KNO3 | 21g | 31g | 45g | 65g | 88g |
| A. | KNO3比KCl的溶解度大 | |
| B. | 两种物质的溶解度相等的温度在20~30℃间 | |
| C. | 在20℃时,10g水中加入5gKCl可得到33.3% 的KCl溶液 | |
| D. | 在50℃时,两物质各5g分别加入l0g水中,充分溶解,均有固体剩余 |
6.下列微粒中,只有还原性的是( )
| A. | Cl- | B. | Cl2 | C. | H+ | D. | Cu2+ |
7.已知酸性高锰酸钾溶液可以将FeSO4 氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4═K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )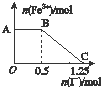

| A. | 方程式中的X为2MnSO4 | |
| B. | 氧化性:KMnO4>Fe3+>I2 | |
| C. | 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol | |
| D. | AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-═2Fe2++I2 |
 (一种常见的化妆品防霉剂),其生产过程如图(反应条件没有全部注明):
(一种常见的化妆品防霉剂),其生产过程如图(反应条件没有全部注明):
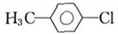 .
. .
.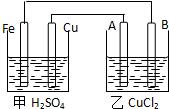 根据图回答以下问题:
根据图回答以下问题: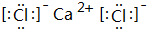 ;
;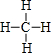 .
.