题目内容
3. 根据图回答以下问题:
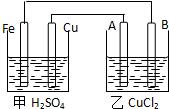
根据图回答以下问题:(A、B均为碳棒,两池中溶液均足量)
(1)甲装置是原电池,乙装置是电解池且Fe极为负极,A极为阳极
(2)A极的电极反应2Cl--2e-=Cl2↑
(3)若甲池中Fe溶解0.3mol,则乙池中产生气体的总体积(标准状况)为6.72L,乙池B极质量会增加19.2g.
分析 铁能自发的进行氧化还原反应,能将化学能转化为电能,所以甲是原电池、乙是电解池,铁作负极、Cu作正极,A是阳极、B是阴极,Fe、Cu、A、B电极上电极反应式分别为:Fe-2e-=Fe2+、2H++2e-=H2↑、2Cl--2e-=Cl2↑、Cu2++2e-=Cu,根据转移电子相等计算生成气体体积.
解答 解:(1)甲中能自发的进行氧化还原反应,能将化学能转化为电能,所以甲是原电池、乙是电解池,铁是易失电子作负极、Cu作正极,则A是阳极、B是阴极,
故答案为:原电;电解;负;阳;
(2)A是阳极,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(3)串联电路中转移电子相等,所以乙中生成气体体积=$\frac{0.3mol×2}{2}$×22.4=6.72L,乙池B极质量会增加0.3×64=19.2g,故答案为:6.72;B;19.2g.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,再结合串联电路中转移电子相等进行计算,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
11.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 25℃、101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
8.下列变化中需加入还原剂才能实现的是( )
| A. | Cl-→Cl2 | B. | CuO→Cu | C. | Fe2+→Fe3+ | D. | H2SO4→BaSO4 |
15.下列各组物质的分类正确的是( )
| A. | 同位素:${\;}_{\;}^{1}$H2O、${\;}_{\;}^{2}$H2O、${\;}_{\;}^{3}$H2O | |
| B. | 同系物:CH4、C2H6、C8H18 | |
| C. | 同素异形体:H2、D2、T2 | |
| D. | 胶体:饱和氯化铁溶液、淀粉溶液、牛奶 |
12.化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等.下列说法正确的是( )
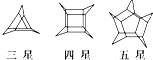

| A. | 它们之间互为同系物 | |
| B. | 六星烷的化学式为C18H23 | |
| C. | 三星烷与丙苯互为同分异构体,四星烷与 互为同分异构体 互为同分异构体 | |
| D. | 它们的一氯代物均只有3种 |
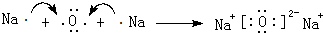 ;C、D还可形成化合物D2C2,D2C2含有的化学键类型是离子键、非极性共价键(或离子键、共价键).
;C、D还可形成化合物D2C2,D2C2含有的化学键类型是离子键、非极性共价键(或离子键、共价键).