题目内容
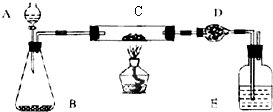
下图是某化学小组在实验室研究二氧化硫催化氧化并制取三氧化硫晶体的装置。
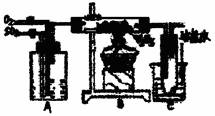
(1)检查装置的气密性,加入药品后,进行实验。A装置可控制SO2和O2的进气量,理论上A中两导管(口径大小相同)冒出气泡的速率应是 ,实验时中两导管冒出气泡的速率大致相同,其原因是 。
A处装的药品是 。C中的实验现象是 ,从C端排出的尾气的成分是 ,为减轻实验对环境污染,请你设计尾气处装置,用简要文字说明所加试剂及操作顺序 。
(2)已知6.4克二氧化硫氧化成气态三氧化硫放出的热量为9.83kJ,该热化学方程式为 ,若将2mol SO2和1 mol O2充入一密闭容器反应,SO2的转化率为9%,此时△= (上述反应的条件相同)。
(3)若将温度从500℃变为400℃时,v(正) ,(填“增大”、“不变”或“减小”,下同),c(SO3):c(SO2)的比值 ,SO2转化率 。
(1)理论上v(O2):v(SO2)=1:2,使价廉的O2过量,提高SO2的转化率。A处装的药品是浓硫酸(干燥水蒸汽)。C中有无色晶体生成。从C端排出的尾气有SO2、O2和SO3,将尾气依次通过浓硫酸的洗气瓶、NaOH溶液的洗气瓶(或足量碱石灰干燥管,只有NaOH溶液吸收不行,SO3溶于水要形成酸雾)
(2)![]() ;△H=-196.6kJ/mol △H=-196.6kJ/mol
;△H=-196.6kJ/mol △H=-196.6kJ/mol
(3)温度降低,v(正)减小,c(SO3)/c(SO2)增大。SO2的转化率增大。

 名校课堂系列答案
名校课堂系列答案 (13分)过氧化钠(化学式为NaNa2O2)可用在呼吸面具中作为氧气来源。Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O = 4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
(1)利用如下图所示实验装置制取氧气,请回答有关问题。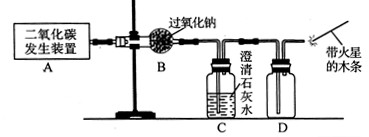
①实验室制取CO2的化学方程式为 。
②表明CO2未被Na2O2完全吸收的实验现象为 。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的 性质。
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是 。
②同学们通过讨论和实验证明了X是Na2CO3。以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整。
| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品, | 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的 溶液 | 有白色沉淀产生 | |
(13分)过氧化钠(化学式为NaNa2O2)可用在呼吸面具中作为氧气来源。Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O = 4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
(1)利用如下图所示实验装置制取氧气,请回答有关问题。
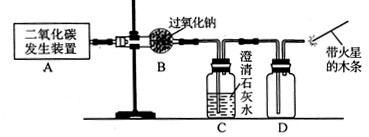
①实验室制取CO2的化学方程式为 。
②表明CO2未被Na2O2完全吸收的实验现象为 。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的 性质。
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是 。
②同学们通过讨论和实验证明了X是Na2CO3。以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整。
|
实验操作 |
现 象 |
有关的化学方程式 |
|
实验一:取少量固体样品,
|
澄清石灰水变浑浊 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
|
实验二:取少量固体样品, 加水配成溶液,滴加适量的 溶液 |
有白色沉淀产生
|
|
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
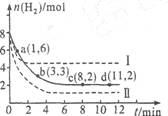
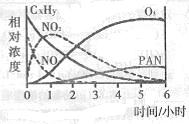
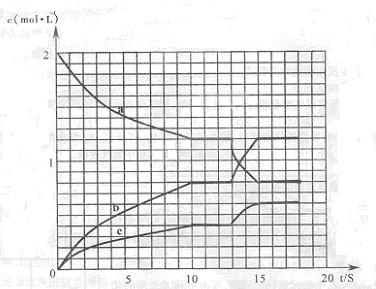
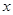 ),可利用甲烷和NO
),可利用甲烷和NO 2NO+O3;△H>0,反应过程中浓度随时间变化的情况如下图所示。
2NO+O3;△H>0,反应过程中浓度随时间变化的情况如下图所示。