��Ŀ����
(13��)��������(��ѧʽΪNaNa2O2)�����ں����������Ϊ������Դ��Na2O2�ܸ�CO2��Ӧ����O2����һ�ֹ��廯����(��X��ʾ)����Ҳ�ܸ�H2O��Ӧ����O2����ѧ����ʽΪ:2Na2O2+2H2O = 4NaOH+O2����������ij��ȤС����е�̽�����
��1����������ͼ��ʾʵ��װ����ȡ��������ش��й����⡣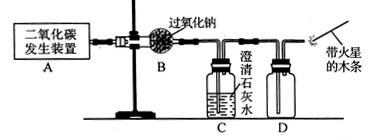
��ʵ������ȡCO2�Ļ�ѧ����ʽΪ ��
�ڱ���CO2δ��Na2O2��ȫ���յ�ʵ������Ϊ ��
��O2�ɲ���Dװ���ռ������ô����ǵ�ľ�����飬����������O2�� ���ʡ�
����Aװ�ò�����CO2�л���ˮ������Ҫ��������CO2�ܷ���Na2O2��Ӧ����O2������ʵ��װ��Ӧ��θĽ�
(2)Ϊ̽��X���������ʼ����й����ʣ�ͬѧ�ǽ��������·�����ʵ�顣
����ͬѧ����X�������ᡢ������е�һ�֡�ͨ����������ɵķ��������һ����ΪX�϶�������ͼ������ ��
��ͬѧ��ͨ�����ۺ�ʵ��֤����X��Na2CO3��������������Ƶ��й�Na2CO3���ʵ�̽��ʵ�飬���±���д������
| ʵ����� | �� �� | �йصĻ�ѧ����ʽ |
| ʵ��һ��ȡ����������Ʒ�� | ����ʯ��ˮ����� | Na2CO3+2HCl=2NaCl+H2O+CO2�� CO2+Ca(OH)2=CaCO3��+H2O |
| ʵ�����ȡ����������Ʒ�� ��ˮ�����Һ���μ������� ��Һ | �а�ɫ�������� | |
(1)��CaCO3+2HCl==CaCl2+H2O+CO2��
�ڳ���ʯ��ˮ�����
�������ܶȱȿ����Ĵ���������ȼ�ԡ�
����A��Bװ��֮�������������װ��
(2)��Na2O2��CO2��������Ԫ�أ����������غ㶨�ɣ����߷�Ӧ�������ɺ���
Ԫ�ص�����(1��)
��
(3)�⣺����������������Ϊx�������������Ƶ�����Ϊy�� ʵ����� �� �� �йصĻ�ѧ����ʽ �μ�ϡ���ᣬȻ����������ͨ�����ʯ��ˮ �����ݲ��� �Ȼ��ƻ�
�Ȼ����� Na2CO3+CaCl2=CaCO3��+2NaCl��
Na2CO3+BaCl2=BaCO3��+2NaCl��
2Na2O2+2H2O=4NaOH+O2��
156 160 32
7.8g y x
X=1.6g
Y=8g
����������Һ�����ʵ���������Ϊ��
8g/40g��100%=20��
���ԡ�
�������������(1)��ʵ�����ô���ʯ��ϡ�����Ʊ�CO2���䷴ӦΪCaCO3+2HCl==CaCl2+H2O+CO2��
��װ��C�еij���ʯ��ˮ���Ǽ���CO2�Ƿ�Ӧ��ȫ�����CO2û�з�Ӧ��ȫ����C�еij���ʯ��ˮ����Ǣ�Dװ�ó����̴��������ſ����ķ�������Ϊ�������ܶȱȿ��������Բ��������ſ������ռ����壬������ʹ�����ǵ�ľ����ȼ������Ϊ����������ȼ�ԡ�����Ϊ�Ƴ���CO2����ˮ������Ҫ��A��B֮���һ������װ��
(2)����Ϊ��Ӧ����Na2O2��CO2������ڲ����в�������HԪ�س��֣��������ж�����HԪ�أ�����X������������ڸ��ݷ�Ӧ����ʽ��֪����������̼���Ʒ�Ӧ��������̼���Ʒ�Ӧ�������Dz������ݡ�����̼���Ƶ����ʿ�֪��̼��������λ��η�Ӧ�������ɫ������
(3)�⣺����������������Ϊx�������������Ƶ�����Ϊy��
2Na2O2+2H2O=4NaOH+O2��
156 160 32
7.8g y x
X=1.6g
Y=8g
����������Һ�����ʵ���������Ϊ��
8g/40g��100%=20��
������������Һ�����ʵ���������Ϊ20%��
���㣺Na2O2�����ʡ�Na2CO3�����ʣ���Һ���������ļ���
����������һ���ۺ���ǿ��ʵ��ϰ�⣬����ʵ��װ�õķ����������������ʵļ��飬������Һ���������ļ��㣬Ҫ����ȷ�������ϰ�⣬����Ҫ����������������ã�Ȼ�����ո������ʵ����ʡ�

 һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�(13��)��������(��ѧʽΪNaNa2O2)�����ں����������Ϊ������Դ��Na2O2�ܸ�CO2��Ӧ����O2����һ�ֹ��廯����(��X��ʾ)����Ҳ�ܸ�H2O��Ӧ����O2����ѧ����ʽΪ:2Na2O2+2H2O = 4NaOH+O2����������ij��ȤС����е�̽�����
��1����������ͼ��ʾʵ��װ����ȡ��������ش��й����⡣
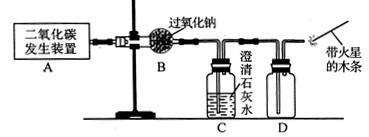
��ʵ������ȡCO2�Ļ�ѧ����ʽΪ ��
�ڱ���CO2δ��Na2O2��ȫ���յ�ʵ������Ϊ ��
��O2�ɲ���Dװ���ռ������ô����ǵ�ľ�����飬����������O2�� ���ʡ�
����Aװ�ò�����CO2�л���ˮ������Ҫ��������CO2�ܷ���Na2O2��Ӧ����O2������ʵ��װ��Ӧ��θĽ�
(2)Ϊ̽��X���������ʼ����й����ʣ�ͬѧ�ǽ��������·�����ʵ�顣
����ͬѧ����X�������ᡢ������е�һ�֡�ͨ����������ɵķ��������һ����ΪX�϶�������ͼ������ ��
��ͬѧ��ͨ�����ۺ�ʵ��֤����X��Na2CO3��������������Ƶ��й�Na2CO3���ʵ�̽��ʵ�飬���±���д������
|
ʵ����� |
�� �� |
�йصĻ�ѧ����ʽ |
|
ʵ��һ��ȡ����������Ʒ��
|
����ʯ��ˮ����� |
Na2CO3+2HCl=2NaCl+H2O+CO2�� CO2+Ca(OH)2=CaCO3��+H2O |
|
ʵ�����ȡ����������Ʒ�� ��ˮ�����Һ���μ������� ��Һ |
�а�ɫ��������
|
|
(3)7.8g����������������ˮ��Ӧ�����������������Ƕ���?����Ӧ��õ���40g����������Һ�����������������Һ�����ʵ�����������