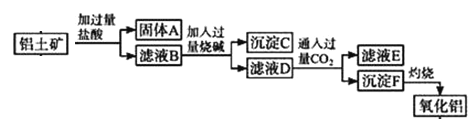
题目内容
【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)该反应的平衡常数表达式为K=___________。
(2)上述反应为_______(填“放热”成“吸热”反应,升高温度,平衡向______(填“正反应”或“逆反应”)方向移动。
(3)800℃时,向恒容密用容器中加入混合物,起始浓度分别为c(CO)=0.01mol/L、c(H2O)=0.03mol/L、c(CO2)=0.1mol/L、c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率____(填“>”"<"或"=")生成速率。
(4)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(g)发生上述反应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=_____mol/(L·min)
②该温度下反应的平衡常数K=________。
(5)可逆反应: CO2(g)+H2(g)![]() CO(g)+H2O(g)的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________。
CO(g)+H2O(g)的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________。

(6)生产水煤气的过程如下:
①C(s)+CO2(g)![]() 2CO(g) △H1
2CO(g) △H1
②C(s)+H2O(g)![]() CO(g)+H2(g) △H2
CO(g)+H2(g) △H2
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
【答案】 ![]() 吸热 正反应 < 0.15 1.8 升高温度 △H1-△H2
吸热 正反应 < 0.15 1.8 升高温度 △H1-△H2
【解析】(1)平衡常数表达式为生成物浓度的幂之积与反应物浓度的幂之积的比值,该反应的平衡常数表达式为K=![]() ;正确答案:
;正确答案:![]() 。
。
(2)根据图表信息可知,温度升高,K增大,该反应正反应为吸热反应;升高温度,平衡向正反应方向移动;正确答案:吸热;正反应 。
(3)根据图表信息可知800℃时,平衡常数为0.9;该反应的浓度商为Q=0.01×0.03/0.1×0.05=0.06<0.9,反应正向进行,H2O的消耗速率小于水的生成速率;正确答案:<。
(4)容器的体积为2L;根据反应方程式
CO2(g) + H2(g) ![]() CO(g)+ H2O(g);
CO(g)+ H2O(g);
起始量 2 4 0 0
变化量 2×75% 2×75% 2×75% 2×75%
平衡量 0.5 2.5 1.5 1.5
①v(H2O)=1.5÷2÷5= 0.15 mol/(L·min);正确答案:0.15。
②平衡后各物质浓度分别为c(CO2)=0.5/2=0.25 mol/L、c(H2)=2.5/2=1.25 mol/L、 c(CO)= c(H2O)=1.5/2=0.75 mol/L;该温度下反应的平衡常数K=0.752/0.25×1.25=1.8;
正确答案:1.8。
(5)根据图像分析,t2时v(正)、v(逆)都增大,且v(正)增加的快,平衡右移;该反应是一个反应前后体积不变的、吸热的可逆反应,增大压强,缩小体积,速率均加快,但是平衡不动,不合题意;升高温度,速率均加快,平衡右移,v(正)增加的快,符合题意;正确答案:升高温度。
(6)根据盖斯定律:用反应①-反应②,整理得CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=△H1-△H2;正确答案:△H1-△H2。
CO(g)+H2O(g) △H=△H1-△H2;正确答案:△H1-△H2。