题目内容
在一定条件下,向体积为2L的容器中加入2mol O2和3mol SO2进行可逆反应:
2SO2(l)+O2(l) 2SO3(l),2min后测得O2的物质的量为1.6mol,则:
2SO3(l),2min后测得O2的物质的量为1.6mol,则:
(1)2min内,SO2的物质的量减少了
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=
2SO2(l)+O2(l)
 2SO3(l),2min后测得O2的物质的量为1.6mol,则:
2SO3(l),2min后测得O2的物质的量为1.6mol,则:(1)2min内,SO2的物质的量减少了
0.8mol
0.8mol
,SO3的物质的量增加了0.8mol
0.8mol
;(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=
0.1mol/(L.min)
0.1mol/(L.min)
;(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=
0.2mol/(L.min)
0.2mol/(L.min)
.分析:(1)根据反应方程式,利用O2反应的物质的量计算SO2减少的物质的量和SO3增加的物质的量;
(2)利用平均化学反应速率公式计算氧气的反应速率;
(3)利用同一反应中,反应速率之比与计量数之比之间的关系计算三氧化硫的化学反应速率.
(2)利用平均化学反应速率公式计算氧气的反应速率;
(3)利用同一反应中,反应速率之比与计量数之比之间的关系计算三氧化硫的化学反应速率.
解答:解:(1)2SO2(g)+O2(g)?2 SO3(g),
反应开始 3mol 2mol 0
2min后 1.6mol
反应 0.8mol 0.4mol 0.8mol
故答案为:0.8mol;0.8mol
(2)由(1)知,△n(O2)=0.4mol,V(O2)=
=
=0.1mol/(L.min)
故答案为:0.1mol/(L.min)
(3)同一反应中,反应速率之比等于其计量数之比,故V(O2):V(SO3)=0.1mol/(L.min):V(SO3)=1:2
V(SO3)=0.2 mol/(L.min)
故答案为:0.2 mol/(L.min)
反应开始 3mol 2mol 0
2min后 1.6mol
反应 0.8mol 0.4mol 0.8mol
故答案为:0.8mol;0.8mol
(2)由(1)知,△n(O2)=0.4mol,V(O2)=
| △n |
| V△t |
| 0.4mol |
| 2L2min |
故答案为:0.1mol/(L.min)
(3)同一反应中,反应速率之比等于其计量数之比,故V(O2):V(SO3)=0.1mol/(L.min):V(SO3)=1:2
V(SO3)=0.2 mol/(L.min)
故答案为:0.2 mol/(L.min)
点评:本题考查了反应速率的定量表示方法,侧重考查学生对有关反应速率计算的掌握程度;根据同一反应中,反应速率之比等于其计量数之比,是解(3)题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
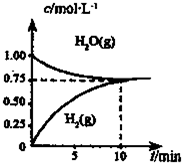 工业上制备合成气的工艺主要是水蒸气重整甲烷:
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4 (g)+H20(g)═C0(g)+3H2(g)△H>0,在一定 条件下,向体积为1L的密闭容器中充入1mol CH4 ( g)和1mol H20(g),测得H2O(g)和H2(g)的浓度随时间变化 曲线如右图所示,下列说法正确的是( )
| A、达平衡时,CH4(g)的转化率为75% | B、O-10 min 内,v(CO)=0.075 mol?L-1.min-1 | C、该反应的化学平衡常数K=O.1875 mol?L-1 | D、当CH4(g)的消耗速率与H20(g)的生成速率相等,反应到达平衡 |
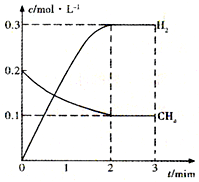 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.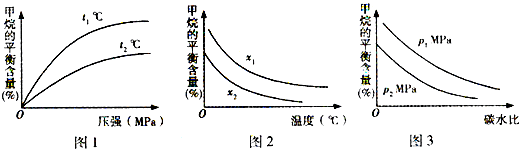
 2SO3,2min时,测得O2的物质的量为1.6mol,则:
2SO3,2min时,测得O2的物质的量为1.6mol,则: