题目内容
 工业上制备合成气的工艺主要是水蒸气重整甲烷:
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4 (g)+H20(g)═C0(g)+3H2(g)△H>0,在一定 条件下,向体积为1L的密闭容器中充入1mol CH4 ( g)和1mol H20(g),测得H2O(g)和H2(g)的浓度随时间变化 曲线如右图所示,下列说法正确的是( )
| A、达平衡时,CH4(g)的转化率为75% | B、O-10 min 内,v(CO)=0.075 mol?L-1.min-1 | C、该反应的化学平衡常数K=O.1875 mol?L-1 | D、当CH4(g)的消耗速率与H20(g)的生成速率相等,反应到达平衡 |
分析:A.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,利用浓度变化量之比等于化学计量数之比计算CH4的浓度变化量,再根据转化率=
×100%计算.
B.利用浓度变化量之比等于化学计量数之比计算CO的浓度变化量,再根据v=
计算v(CO);
C.利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态.
| 浓度变化量 |
| 起始浓度 |
B.利用浓度变化量之比等于化学计量数之比计算CO的浓度变化量,再根据v=
| △c |
| △t |
C.利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态.
解答:解:A.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CH4)=
△c(H2)=
×0.75mol/L=0.25mol/L,故甲烷的转化率为:
×100%=25%,故A错误;
B.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CO)=
△c(H2)=
×0.75mol/L=0.25mol/L,则v(CO)=
=0.025 mol?L-1?min-1,故B错误;
C.平衡时H2的浓度变化量为0.75mol/L,则:
CH4 (g)+H20(g)═C0(g)+3H2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.25 0.25 0.25 0.75
平衡(mol/L):0.75 0.75 0.25 0.75
故该温度下平衡常数k=
=O.1875 mol2?L-2,故C错误;
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态,当CH4(g)的消耗速率与H20(g)的生成速率相等,等于化学计量数之比,说明到达平衡,故D正确;
故选D.
| 1 |
| 3 |
| 1 |
| 3 |
| 0.25mol/L |
| 1mol/L |
B.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CO)=
| 1 |
| 3 |
| 1 |
| 3 |
| 0.25mol/L |
| 10min |
C.平衡时H2的浓度变化量为0.75mol/L,则:
CH4 (g)+H20(g)═C0(g)+3H2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.25 0.25 0.25 0.75
平衡(mol/L):0.75 0.75 0.25 0.75
故该温度下平衡常数k=
| 0.25×0.753 |
| 0.75×0.75 |
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态,当CH4(g)的消耗速率与H20(g)的生成速率相等,等于化学计量数之比,说明到达平衡,故D正确;
故选D.
点评:本题考查化学平衡图象、反应速率计算、平衡常数计算、化学平衡有关计算、平衡状态的判断等,难度中等,C选项为易错点,容易忽略平衡常数的单位.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
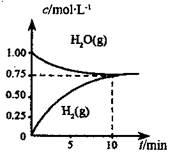
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g) CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )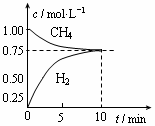
| A.10min时用CH4表示的反应速率为0.075 mol?L-1?min-1 |
| B.使用高效催化剂能够增大CO的产率 |
| C.该条件下反应的平衡常数为0.1875 |
D.升高温度能使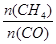 增大 增大 |
 CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )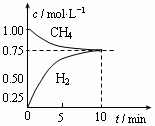
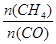 增大
增大