题目内容
【题目】标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.6g,则:
(1)混合气体平均相对分子量为____;一氧化碳的质量为_____。
(2)将上述混合气体与标准状况下16.8L的氧所混合点燃,完全反应后,冷却至标准状况,反应后混合气体的平均相对分子质量为_____。
【答案】19 2.8g 41.6
【解析】
(1)设出甲烷和一氧化碳的物质的量,根据n=![]() =
=![]() 列式计算;
列式计算;
(2)判断氧气与混合气体的反应程度,进而确定冷却后气体的组成及所得气体的相对分子质量。
(1)标况下8.96L气体的物质的量为:![]() =0.4mol,混合气体平均摩尔质量为:
=0.4mol,混合气体平均摩尔质量为:![]() =19g/mol,则混合气体平均相对分子量为19;
=19g/mol,则混合气体平均相对分子量为19;
设混合气体中甲烷、CO的物质的量分别为x、y,则:x+y=0.4mol、16x+28y=7.6g,解得:x=0.3mol、y=0.1mol;一氧化碳的质量为:28g/mol×0.1mol=2.8g;
(2)将上述混合气体与标准状况下16.8L的氧气混合点燃,氧气的物质的量为:![]() =0.75mol,发生反应为CH4+2O2=CO2+2H2O消耗氧气0.6mol、2CO+O2=2CO2消耗氧气0.05mol,则混合气体完全反应消耗氧气的物质的量为:0.6mol+0.05mol=0.65mol<0.75mol,说明氧气过量,反应后混合气体中含有0.4molCO2、0.1molO2,则混合气体的平均摩尔质量为:
=0.75mol,发生反应为CH4+2O2=CO2+2H2O消耗氧气0.6mol、2CO+O2=2CO2消耗氧气0.05mol,则混合气体完全反应消耗氧气的物质的量为:0.6mol+0.05mol=0.65mol<0.75mol,说明氧气过量,反应后混合气体中含有0.4molCO2、0.1molO2,则混合气体的平均摩尔质量为:![]() =41.6g/mol,混合气体的平均相对分子质量为41.6。
=41.6g/mol,混合气体的平均相对分子质量为41.6。

【题目】下列实验能达到预期目的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快 | 证明HX酸性比HY强 |
D | 向10mL 0.2mol/L NaOH溶液中滴2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下Ksp: Mg(OH)2>Fe(OH)3 |
A. AB. BC. CD. D
【题目】按要求回答下列问题
(1)我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
①磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=_____________________。
②在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Cd的相对原子质量:112);此时是否符合水源标准?______(填“是”或“否”)。
(2)炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
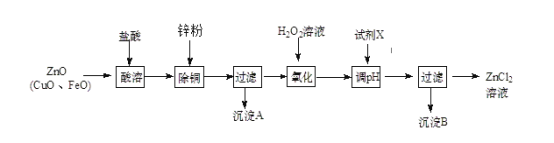
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
①加入H2O2溶液的作用是________________。
②流程图中,调节pH时,加入的试剂X可以是________(填序号);
a、ZnO b、NaOH c、Zn2(OH)2CO3 d、ZnSO4
pH应调整到______________________。