题目内容
【题目】下列图示与对应的叙述相符的是( )
A.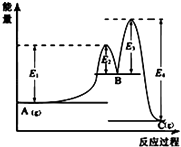 图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJmol﹣1
图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJmol﹣1
B.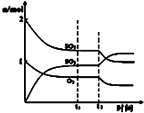 图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.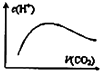 图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D.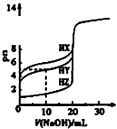 图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
【答案】C
【解析】解:A.整个反应中△H=(E1﹣E2)+(E2﹣E3)﹣E4=E1﹣E3﹣E4 , 故A错误;B.如果t2时扩大容器的体积,则各种物质的浓度瞬间变小,浓度曲线不是连续的,故B错误;
C.NaOH溶液呈碱性对水的电离起抑制作用,水电离氢离子浓度较小,通入二氧化碳,氢氧化钠的浓度减小,对水的抑制程度较小,水电离的氢离子浓度增大,当二氧化碳过量时,二氧化碳与水反应生成碳酸又抑制水的电离,水电离的氢离子浓度减小,与图象相符合,故C正确;
D.氢氧化钠体积为0时,0.1000molL﹣1的三种酸HX、HY、HZ的PH分别约为4、2.5、1,故酸性大小为HX<HY<HZ,故D错误;
故选C.
【考点精析】本题主要考查了反应热和焓变和化学平衡状态本质及特征的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.

【题目】元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是
X | Y | Z | |
W | Q | M |
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为![]() 其二氢取代物有两种
其二氢取代物有两种
C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
【题目】下列物质分类正确的是( )
序号 | 电解质 | 酸 | 氧化物 | 单质 | 酸性氧化物 |
A | Cl2 | FeBr2 | CO | Hg(汞) | FeCl3 |
B | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
C | KClO3 | HCl | CaO | Cl2 | CO2 |
D | K2O | HCl(浓) | H2O | Cl2 | MnO2 |
A. AB. BC. CD. D