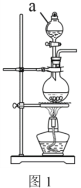
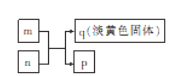
题目内容
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
【答案】D
【解析】A.在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,故A正确;B.在CaF2晶胞中含有Ca2+数为8×![]() +6×
+6×![]() =4,故B正确;C.金刚石晶体中碳原子杂化方式为sp3,6个碳原子形成一个环且不在同一平面上,故C正确;D.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D错误;故选D。
=4,故B正确;C.金刚石晶体中碳原子杂化方式为sp3,6个碳原子形成一个环且不在同一平面上,故C正确;D.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D错误;故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下列操作对应的现象不符合事实的是
|
|
|
|
A.将二氧化碳气体通入CaCl2溶液,不会产生白色沉淀 | B.用激光笔照射Fe(OH)3胶体,产生“丁达尔效应” | C.将湿润的有色布条放入盛有干燥氯气的瓶中,布条不褪色 | D.将滴管中的浓盐酸加入碳酸氢钠溶液,气球体积由小变大 |
A. A B. B C. C D. D