题目内容
2.在浓硝酸中放入铜片:(1)实验现象为铜片逐渐溶解,溶液变蓝色,有红棕色气体产生;
(2)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况).则所消耗硝酸的物质的量是0.65 mol.
分析 (1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,二氧化氮是红棕色气体,铜盐溶液呈蓝色;
(2)硝酸盐在酸性条件下具有硝酸的氧化性,则能继续与铜反应;
(3)铜和硝酸反应生成硝酸铜与氮的氧化物(NO或NO2或NO、NO2的混合物),反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量.
解答 解:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮是红棕色气体,铜盐溶液呈蓝色,所以看到的现象是:溶铜片逐渐溶解,溶液变蓝色,有红棕色气体产生,故答案为:铜片逐渐溶解,溶液变蓝色,有红棕色气体产生;
(2)硝酸盐在酸性条件下具有硝酸的氧化性,则能与铜与氢离子、硝酸根离子继续反应生成NO,所以离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)12.8gCu的物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol;
故答案为:0.65mol.
点评 本题考查了硝酸的性质及氧化还原反应计算,难度中等,注意利用氮原子个数守恒和得失电子数守恒思想计算.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
12. 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、500 mL 容量瓶、胶头滴管以及等质量的几片滤纸.
(2)计算.配制该溶液需取NaCl晶体的质量为14.6g.
(3)称量.
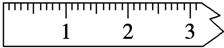
①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的左盘(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解.该步实验中需要使用玻璃棒,目的是搅拌,加速溶解.
(5)转移、洗涤.在转移时应使用玻璃棒引流,洗涤烧杯2~3次是保证溶质全部转移至容量瓶中.
(6)定容,摇匀.
(7)在配制溶液(或者稀释浓溶液)的过程中,存在引起误差的一些错误操作,可能造成所配溶液的浓度会受到影响,请完成表格(在空格处填偏大、偏小或者无影响).
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、500 mL 容量瓶、胶头滴管以及等质量的几片滤纸.
(2)计算.配制该溶液需取NaCl晶体的质量为14.6g.
(3)称量.
①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的左盘(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解.该步实验中需要使用玻璃棒,目的是搅拌,加速溶解.
(5)转移、洗涤.在转移时应使用玻璃棒引流,洗涤烧杯2~3次是保证溶质全部转移至容量瓶中.
(6)定容,摇匀.
(7)在配制溶液(或者稀释浓溶液)的过程中,存在引起误差的一些错误操作,可能造成所配溶液的浓度会受到影响,请完成表格(在空格处填偏大、偏小或者无影响).
| 引起误差的一些错误操作 | 对CB的影响 |
| 定容时,俯视刻度线 | 偏大 |
| 转移溶液时,玻璃棒下端靠在容量瓶刻度线以上 | 偏小 |
| 洗涤量取浓溶液的量筒并将洗涤液转移到容量瓶 | 偏大 |
| 定容后,经振荡、摇匀、静置、液面低于刻度线再加水 | 偏小 |
13.工厂用FeCl3溶液腐蚀表面有铜的印刷电路板,课外活动小组为确定生产后废液的组成,进行如下实验:
①取10.0mol废液加入足量的AgNO3溶液,产生沉淀8.61g
②另取10.0mol废液放入足量铜片充分反应,铜片质量减少了0.256g,下列关于原废液组成的判断正确的是( )
①取10.0mol废液加入足量的AgNO3溶液,产生沉淀8.61g
②另取10.0mol废液放入足量铜片充分反应,铜片质量减少了0.256g,下列关于原废液组成的判断正确的是( )
| A. | 只含有Fe2+、Cu2+、Cl- | |
| B. | c(Fe2-):c(Cu2+)=1:2 | |
| C. | c(Cl-)=6.0mol.L-1,c(Fe2+)=1.2mol.L-1 | |
| D. | c(Fe2+):c(Fe3+)=3:1 |
10.在下列有色试剂褪色现象中,其褪色原理相同的是( )
| A. | 乙烯能使溴水和酸性KMnO4溶液褪色 | |
| B. | Cl2和SO2均能使品红褪色 | |
| C. | 苯和乙炔都能使溴水褪色 | |
| D. | 甲苯和乙醛均能使酸性KMnO4溶液褪色 |
17.下列推断合理的是( )
| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| B. | 向50mL 18mol/L 硫酸中加入足量铜片并加热,被还原硫酸的物质的量是0.45mol | |
| C. | 浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色 |
7.室温下,1mol无水硫酸铜(CuSO4)溶于水放出a kJ的热,胆矾(CuSO4•5H2O)受热失水的热化学方程式为CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(s)△H=+b kJ/mol,又知胆矾溶于水会使溶液温度降低,则a、b的关系为( )
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
11.甲苯与苯的性质相似,但甲苯能使酸性KMnO4溶液褪色.现有己烯(液态、化学性质与乙烯类似)、苯和甲苯3份无色液体,下列能将3份液体鉴别开的试剂是( )
| A. | 酸性KMnO4溶液 | B. | 溴水 | ||
| C. | NaOH溶液 | D. | 酸性KMnO4溶液和溴水 |
12.“北大富硒康”中含有微量元素硒(Se),对人体有保健作用.已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,硒不可能具有的性质为( )
| A. | 硒化氢很稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 非金属性比硫弱 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
 有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题:
有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题: (写结构简式)可以合成二肽
(写结构简式)可以合成二肽