题目内容
17.下列说法不正确的是( )| A. | 任何化学反应,只要化学反应的速率很快,理论上都能设计成原电池 | |
| B. | 中和反应一定是放热反应 | |
| C. | 化学反应的速率可通过改变条件而改变 | |
| D. | 化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
分析 A、只有自发的、放热的氧化还原反应才能设计成原电池;
B、中和反应是放热反应;
C、化学反应速率受到外界条件的影响;
D、平衡标志是正逆反应速率相同,各成分浓度不变.
解答 解:A、电子的定向移动形成电流,故只有自发的、放热的氧化还原反应才能设计成原电池,非氧化还原反应不能设计成原电池,故A错误;
B、中和反应的反应物的总能量一定大于生成物的总能量,故一定是放热反应,故B正确;
C、化学反应速率受到外界条件的影响,故可以通过改变外界条件来改变反应速率,故C正确;
D、平衡标志是正逆反应速率相同,各成分浓度不变,化学反应达到平衡状态时,只要条件不改变各物质的浓度就不再改变,故D正确.
故选A.
点评 本题考查了影响化学平衡、化学反应速率的因素的分析判断,应注意的是只有自发的、放热的氧化还原反应反应才能设计成原电池,题目较简单.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
7.化学方程式可简明地体现元素及其化合物的性质.已知:
氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl;
2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI;
3I2+6KOH═5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3═2KSCN+CO2↑+H2O;
KCN+CO2+H2O═HCN+KHCO3
热分解反应:4NaClO$\frac{\underline{\;\;△\;\;}}{\;}$3NaCl+NaClO4;NaClO4$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2O2↑
下列说法不正确是:( )
氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl;
2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI;
3I2+6KOH═5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3═2KSCN+CO2↑+H2O;
KCN+CO2+H2O═HCN+KHCO3
热分解反应:4NaClO$\frac{\underline{\;\;△\;\;}}{\;}$3NaCl+NaClO4;NaClO4$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2O2↑
下列说法不正确是:( )
| A. | 酸性(吸水溶液):HSCN>H2CO3>HCN | B. | 还原性(碱性溶液):Fe(OH)2>I->KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 氧化性(酸性溶液):I2>FeCl3>Co(OH)3 |
8.一定条件下,4mol A气体和2mol B气体在2L的密闭容器中发生反应:2A(g)+B(g)?3C(g),经2s后测得C的浓度为0.9mol•L-1,下列说法正确的是( )
| A. | 2s末A和B的转化率相同 | |
| B. | 2s末A的浓度为0.6mol/L | |
| C. | 反应速率$\frac{{v}_{(A)}}{{v}_{(B)}}$=$\frac{1}{2}$ | |
| D. | 用B表示的平均反应速率为0.3mol/(L•s) |
5.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指单位时间内反应物浓度的减少或生成物浓度的增加 | |
| B. | 化学反应速率为“1.0mol/(L.s)”表示的意思是:时间为1s时,某物质的浓度为1.0mol/L | |
| C. | 化学反应速率也有大小也有方向 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
9.下列关于能量转换的认识中,不正确的是( )
| A. | 煤燃烧时化学能主要转化为热能 | |
| B. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| C. | 电解水生成氢气和氧气,电能转化为化学能 | |
| D. | 白炽灯工作时,电能转化为化学能 |
6.下列变化中一定为放热的化学反应的是( )
| A. | H2O(g)═H2O(l)△H=-44.0 kJ•mol-1 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+182.6 kJ•mol-1 | |
| C. | 形成化学键过程中放出862 kJ热量的化学反应 | |
| D. | 能量变化如图所示的化学反应.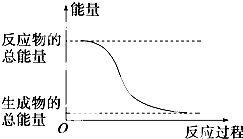 |
7.2005年10月12日我国用长征二号F型火箭成功发射了神舟“六号”载人飞船,并于10月17日圆满着陆.标志着我国载人航天又有新的突破.长征二号F型火箭用的燃料是液态的偏二甲基肼(C2H8N2),氧化剂是液态的N2O4,已知1.5g火箭燃料偏二甲基肼完全燃烧生成氮气,二氧化碳和液态水放出热量50kJ.下列说法不正确的是( )
| A. | 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能 | |
| B. | 偏二甲基肼在四氧化氮中的燃烧反应是放热反应 | |
| C. | 该反应中偏二甲基肼和四氧化氮总能量小于二氧化碳、氮气和水的总能量 | |
| D. | 燃烧时的总反应为:C2H8N2+2N2O4$\stackrel{点燃}{→}$2CO2+3N2+4H2O |
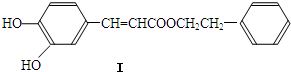
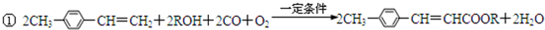
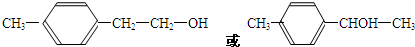 (写1种);由IV生成II的反应条件为NaOH醇溶液,加热.
(写1种);由IV生成II的反应条件为NaOH醇溶液,加热.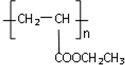 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为(提示:共有两步反应方程式)CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{催化剂}{→}$2CH2=CHCOOCH2CH3+2H2O.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为(提示:共有两步反应方程式)CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{催化剂}{→}$2CH2=CHCOOCH2CH3+2H2O.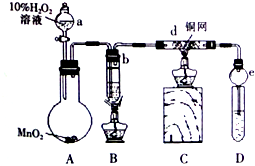 某校课外活动小组的同学在完成课本乙醇氧化制乙醛的实验后,改进了实验方案(如图),进行如下实验操作(顺序已打乱):
某校课外活动小组的同学在完成课本乙醇氧化制乙醛的实验后,改进了实验方案(如图),进行如下实验操作(顺序已打乱):