题目内容
【题目】氨在国民经济中占有重要地位。完成合成氨工业中有关问题。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①高温高压、催化剂条件下,工业合成氨的热化学方程式为:____________________________________________。
②若起始时向容器内放入0.2 mol N2和0.6 mol H2,达到平衡后放出的热量为Q,则Q值______18.44 kJ(填“﹥”“=”或“﹤”)。
(2)NH3(g)与CO2(g) 经过两步反应合成尿素(CO(NH2)2),两步反应的能量变化示意图如下:

①则2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
②在一定温度和压强下,若①中的反应,NH3和CO2的物质的量之比(氨碳比)n(NH3)/n(CO2)=x。下图是氨碳比(x)与CO2平衡转化率(α)的关系。

α随着x增大而增大的原因是_________________________________。
③图中B点处,NH3的平衡转化率_______________。
(3)将N2和H2各1 mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,N2的体积分数将_______________(填序号)。
a.一直减小 b.始终不变 c.一直增大 d.无法确定
【答案】 N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g) ![]() H=-92.2kJ/mol ﹤ -134 c(NH3)增大,平衡正向移动 32% b
H=-92.2kJ/mol ﹤ -134 c(NH3)增大,平衡正向移动 32% b
【解析】试题分析:(1)①热化学方程式要标出反应物、生成物的聚集状态、放热反应焓变为负值;②该反应为可逆反应, 0.2 mol N2和0.6 mol H2生成氨气的物质的量小于0.4mol;(2)①根据图示2NH3(g)+CO2(g) ![]() H2NCOONH4(s) ΔH= -272 kJ/mol;H2NCOONH4(s)
H2NCOONH4(s) ΔH= -272 kJ/mol;H2NCOONH4(s) ![]() CO(NH2)2(s)+H2O(l) ΔH=+138 kJ/mol,根据盖斯定律计算2NH3(g)+CO2(g)
CO(NH2)2(s)+H2O(l) ΔH=+138 kJ/mol,根据盖斯定律计算2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) 的焓变;② x增大,说明增大氨气的浓度,平衡正向移动;③利用“三段式”计算B点处,NH3的平衡转化率;(3)设参加反应的氮气的物质的量为xmol,根据“三段式”计算N2的体积分数。
CO(NH2)2(s)+H2O(l) 的焓变;② x增大,说明增大氨气的浓度,平衡正向移动;③利用“三段式”计算B点处,NH3的平衡转化率;(3)设参加反应的氮气的物质的量为xmol,根据“三段式”计算N2的体积分数。
解析:(1)①热化学方程式要标出反应物、生成物的聚集状态、放热反应焓变为负值,高温高压、催化剂条件下,工业合成氨的热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g) ![]() H=-92.2kJ/mol;②该反应为可逆反应, 0.2 mol N2和0.6 mol H2生成氨气的物质的量小于0.4mol,所以达到平衡后放出的热量为Q<18.44 kJ;(2)①根据图示2NH3(g)+CO2(g)
H=-92.2kJ/mol;②该反应为可逆反应, 0.2 mol N2和0.6 mol H2生成氨气的物质的量小于0.4mol,所以达到平衡后放出的热量为Q<18.44 kJ;(2)①根据图示2NH3(g)+CO2(g) ![]() H2NCOONH4(s) ΔH= -272 kJ/mol;②H2NCOONH4(s)
H2NCOONH4(s) ΔH= -272 kJ/mol;②H2NCOONH4(s) ![]() CO(NH2)2(s)+H2O(l) ΔH=+138 kJ/mol,根据盖斯定律①+②得2NH3(g)+CO2(g)
CO(NH2)2(s)+H2O(l) ΔH=+138 kJ/mol,根据盖斯定律①+②得2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) ΔH= -134kJ/mol;② x增大,说氨气的浓度增大,平衡正向移动,所以CO2平衡转化率增大;③设B点CO2的投料为x,则NH3的投料为4x;
CO(NH2)2(s)+H2O(l) ΔH= -134kJ/mol;② x增大,说氨气的浓度增大,平衡正向移动,所以CO2平衡转化率增大;③设B点CO2的投料为x,则NH3的投料为4x;

![]() 32% ;
32% ;
(3)设参加反应的氮气的物质的量为xmol,

N2的体积分数为![]() , 所以N2的体积分数始终不变,故b正确。
, 所以N2的体积分数始终不变,故b正确。

【题目】高铁酸钾(K2FeO4) 易溶于水。受热分解生成氧气。高铁酸钾的工业制法有多种,其中一种的主要步骤如图所示(方框内为主产物)。
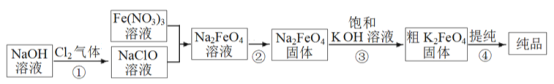
(1)①中反应的离子方程式是_____________________________。
(2)③中的反应为: Na2FeO4(s)+2KOH(aq) ![]() K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
(3) 提纯粗K2FeO4采用的方法是___________________(选填“萃取”、“蒸馏”、“重结晶”)。提纯过程中溶解粗K2FeO4 固体应选用__________(填序号)。
A.水 B.稀硫酸 C.KOH 溶液 D.NaOH 溶液
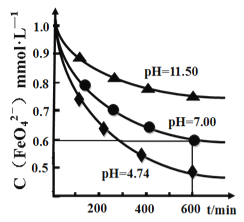
(4)某温度下,高铁酸钾溶液在不同pH 下的分解曲线如图所示。为延长高铁酸钾溶液的保存时间,可采取的措施是________________;完成pH>7 时的化学反应方程式配平:__ K2FeO4 +___=___KOH+___Fe(OH)3↓+________,____________________
(5)用高铁酸钾处理污水,能去污、杀菌、消毒,且自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现用两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30mg K2FeO4,相同温度下最终去除效果见下表。
项目 | 葡萄糖溶液 | 甲苯溶液 |
起始COD/(mg·L-1) | 1124 | 1966 |
处理后COD/(mg·L-1) | 983 | 526 |
去除率/% | 11.54 | 73.24 |
已知: 化学需氧量(COD) 指的是: 在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧气的亳克数,以mg·L-1表示。该指标也作为污水中有机物含量的综合指标之一。由甲苯引起的1L 污水,当去除率为73.24%时,理论上需高铁酸钾_____mg。[ 已知 :M(K2FeO4)=198g/mol]。理论上需要的m (Na2FeO4 ) 大于实际用量,说明Na2FeO4 去除有机污水的原理除了氧化作用外,另一个原因可能是_____________________________。