��Ŀ����
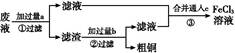
���ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��,����ӡˢ��·�塣ij����ʦΪ�˴ӷ�Һ�л���ͭ,���»��FeCl3��Һ,���������ʵ�鲽��:
д��һ����֤����ԭ��Fe��Cuǿ�����ӷ���ʽ: ��
�÷�Ӧ����ͼ���� �з����������������Ӧ���һ��ԭ���,�ڷ����л�������װ��ͼ(����缫���ơ��缫���ϡ��������Һ)��
�������̻��յ�ͭ�Ǵ�ͭ,Ϊ�˻�ø�����ͭ������е�⾫����д����⾫��ʱ�������ϼ���Ҫ�ĵ缫��Ӧʽ ��

д��һ����֤����ԭ��Fe��Cuǿ�����ӷ���ʽ: ��
�÷�Ӧ����ͼ���� �з����������������Ӧ���һ��ԭ���,�ڷ����л�������װ��ͼ(����缫���ơ��缫���ϡ��������Һ)��
| |
Fe+Cu2+=Fe2++Cu ��
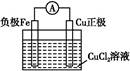
��ͭ,Cu-2e-=Cu2+

��ͭ,Cu-2e-=Cu2+
���������Ϣ��֪��ҺӦΪFeCl3��CuCl2��FeCl2�Ļ����Һ,������Լ�aΪFe,������ӦΪ:Fe+2Fe3+=3Fe2+��Fe+Cu2+=Cu+Fe2+,���ٹ��˺�,������Fe��Cu�Ļ����,�ټ��������b(����)������Ӧ:Fe+2HCl=FeCl2+H2��,���ڹ��˺���Һ��Ҫ��FeCl2��Һ,���ϲ������Һ��ͨ��c(Cl2),������Ҫ��ӦΪ:2Fe2++Cl2=2Fe3++2Cl-��Fe+Cu2+=Fe2++Cu����֤��Fe��Cu��ԭ��ǿ,�÷�Ӧ�ڲ�����з�������Fe+Cu2+=Fe2++Cu��Ƴ�ԭ���,Fe������,��Fe�����õ�Cu����������,�������Һ�Ǻ�Cu2+����Һ����⾫��ͭʱ,��ͭ������,��ͭ��������

��ϰ��ϵ�д�
�����Ŀ
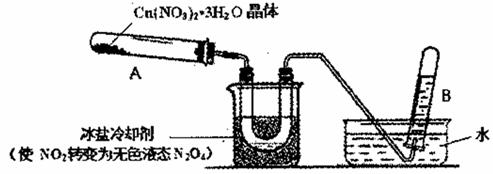
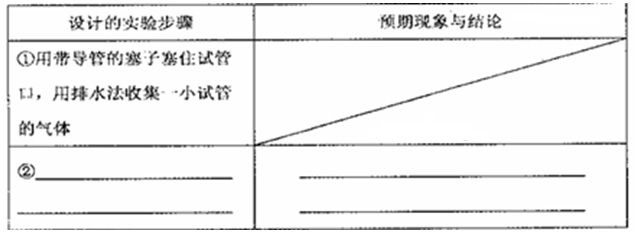

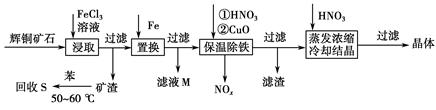
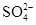 ���ɣ�������Һ�еμ�Ba��NO3��2��Һ
���ɣ�������Һ�еμ�Ba��NO3��2��Һ Fe2O3+SO2��+SO3����
Fe2O3+SO2��+SO3����