题目内容
6.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是( )
| A. | Cl2+2KBr═Br2+2KCl | B. | 2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2 | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
分析 由图可知,阴影部分为氧化还原反应,但不是置换反应,反应中含元素的化合价变化为氧化还原反应,结合物质类别及反应类型来解答.
解答 解:A.Cl、Br元素的化合价变化,为氧化还原反应,且属于置换反应,故A不选;
B.无元素的化合价变化,为非氧化还原反应,故B不选;
C.为化合物反应,故C不选;
D.O元素的化合价变化,为氧化还原反应,且不属于置换反应等四种基本反应类型,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、反应类型为解答本题关键,侧重分析与应用能力的考查,注意反应的分类依据,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
16.如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数.下列说法正确的是
( )
( )
| X | ||
| Y | Z | W |
| T |
| A. | 含Y元素的盐水溶液可呈酸性或碱性 | |
| B. | 气态氢化物的稳定性:X>W>Z | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | Z单质性质不活泼.在自然界中有游离态 |
14. 298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
 298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )| A. | 该滴定过程应该选择甲基橙作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<13 |
1.一定条件下的反应:PCl5(g)?PCl3(g)+Cl2(g)△H>0.达到平衡后,下列情况使PCl5分解率降低的是( )
| A. | 温度不变,增大容器体积 | B. | 体积不变,对体系加热 | ||
| C. | 温度和体积不变,充入氩气 | D. | 温度和体积不变,充入氯气 |
11.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 蛋白质和油脂一定条件下都能水解 | |
| B. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 与有机物 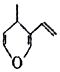 互为同分异构体,且能与NaOH溶液反应的化合物有7种 互为同分异构体,且能与NaOH溶液反应的化合物有7种 |
18.如图甲是利用一种微生物将废水中尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在乙中的铁上镀铜.下列说法中不正确的是( )


| A. | 铜电极应与Y电极相连接 | |
| B. | H十透过质子交换膜由左向右移动 | |
| C. | 当N电极消耗0.25mol气体时,则铁电极增重16g | |
| D. | M电极反应式为:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ |
15.三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池.工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是Na2CO3和NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为10 g•L-1.

(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4•2H2O).草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体.草酸镍晶体受热分解的化学方程式为2NiC2O4•2H2O$\frac{\underline{\;高温\;}}{\;}$Ni2O3+3CO↑+CO2↑+4H2O.

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是Na2CO3和NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为10 g•L-1.

(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4•2H2O).草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体.草酸镍晶体受热分解的化学方程式为2NiC2O4•2H2O$\frac{\underline{\;高温\;}}{\;}$Ni2O3+3CO↑+CO2↑+4H2O.
 某研究小组欲研究Fe2+的部分性质.
某研究小组欲研究Fe2+的部分性质.