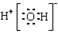题目内容
(1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等 体积混合,溶液的pH= 。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,溶液的pH= 。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①某溶液中的H+浓度为1×10-7mol/L,则该溶液呈 性。
②0.01mol/LNaOH溶液的pH= 。
③99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,溶液的pH= 。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,溶液的pH= 。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①某溶液中的H+浓度为1×10-7mol/L,则该溶液呈 性。
②0.01mol/LNaOH溶液的pH= 。
③99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,溶液的pH= 。
(1)① 7 。② 3.3 。
(2 )① 碱 。② 11 。③ 10 。
(2 )① 碱 。② 11 。③ 10 。
试题分析:(1)①pH=3的盐酸中,c(H+)=0.001,pH=11的氢氧化钡中,c(OH-)=0.001,所以两者等体积混合,在常温下,溶液的pH=7;②常温下pH=3的盐酸,c(H+)=0.001,pH=6的盐酸c(H+)=10-6,所以两者等体积混合,c(H+)=(0.001+10-6)/2≈0.0005,所以pH=-lg0.0005=3.3;(2)H2O的离子积常数为1×10-13,①H+浓度为1×10-7mol/L,所以c(OH-)=1×10-13/1×10-7=1×10-6mol/L,所以c(OH-)>c(H+),所以该溶液呈碱性;②0.01mol/LNaOH溶液中,c(OH-)=0.01,所以c(H+)=1×10-13/0.01=1×10-11mol/L,所以pH=11;③c(OH-)=(0.101×0.1-0.099×0.1)/(0.101+0.099)=0.001,所以c(H+)=1×10-13/0.001=1×10-10mol/L,,所以pH=10。
点评:本题考查了pH的计算,注意第二小题水的离子积为1×10-13,该题难度适中。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目