题目内容
H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-若向H2S溶液中
H++S2-若向H2S溶液中
| A.加水,平衡向右移动,溶液中氢离子浓度增大 |
| B.通入过量SO2气体,平衡向左移动,溶液pH值增大 |
| C.滴加新制氯水,平衡向左移动,溶液pH值减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |
C
解析

练习册系列答案
相关题目
25℃时,某浓度的NH4Cl溶液pH = 4,下列叙述正确的是
| A.溶液中的 c(OH-) = 1×10-10 mol·L-1 |
| B.溶液中的c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.溶液中的c(H+) + c(NH4+) = c(Cl-) + c(OH-) |
| D.溶液中的c(NH3·H2O) = c(NH4+) |
下列物质中,属于弱电解质的是( )
| A.氨水 | B.冰醋酸 | C.酒精 | D.硫酸钡 |
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是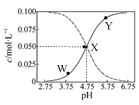
| A.Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B.W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol·L-1 |
| C.该温度下醋酸的电离平衡常数为10—4.75 mol·L-1 |
| D.向X点所表示的溶液中加入等体积的0.05 mol·L-1 NaOH溶液 :c(H+)=c(CH3COOH)+c(OH-) |
250C时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图7 所示。下列有关溶液中离子浓度关系的叙述正确的是
| A.pH="5." 5 的溶液中: c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.W 点所表示的溶液中: c(Na+)+c(H+)= c(CH3COOH)+c(OH-) |
| C.pH =" 3." 5 的溶液中: c(Na+) +c(H+) -c(OH-) +c(CH3COOH)=0.1mol·L-1 |
| D.向W 点所表示的1.0L 溶液中通入0.05mol HCl 气体(溶液体积变化可忽略): c(H+)= c(CH3COOH)+c(OH-) |
0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(HF)>c(OH-) | D.c(HF)>c(F-) |
下列有关溶度积常数Ksp的说法正确的是
| A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小 |
| B.溶度积常数Ksp只受温度影响,温度升高Ksp减小 |
| C.溶度积常数Ksp只受温度影响,温度升高Ksp增大 |
| D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变 |
已知25℃时一些难溶物质的溶度积常数如下:
| 化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
| 溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
根据上表数据,判断下列化学方程式不正确的是( )
A.2AgCl+Na2S=2NaCl+Ag2S
B.MgCO3+H2O△,Mg(OH)2+CO2↑
C.ZnS+2H2O=Zn(OH)2+H2S↑
D.Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O