题目内容
25℃时,某浓度的NH4Cl溶液pH = 4,下列叙述正确的是
| A.溶液中的 c(OH-) = 1×10-10 mol·L-1 |
| B.溶液中的c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.溶液中的c(H+) + c(NH4+) = c(Cl-) + c(OH-) |
| D.溶液中的c(NH3·H2O) = c(NH4+) |
AC
解析试题分析:A.NH4Cl溶液pH = 4,c(H+)=10-4mol/L.由于在25℃时Kw=10-14,所以溶液中的 c(OH-) = Kw÷c(H+)=1×10-10 mol/L。正确。B.NH4Cl是强酸弱碱盐,弱碱根NH4+离子发生水解反应而消耗,所以c(Cl-) >c(NH4+);弱碱根NH4+离子发生水解反应消耗水电离产生的OH-,使水的电离平衡被破坏,水继续电离,当最终达到电离平衡时,c(H+)>c(OH-)。盐水解的程度是很微弱的,因此c(NH4+)>c(H+)。故整个溶液中离子浓度关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。错误。C.根据电荷守恒可知溶液中的c(H+) + c(NH4+) = c(Cl-) + c(OH-)。正确。D.在溶液中NH3·H2O 是盐水解产生的,而NH4+是盐电离产生的。在溶液中盐水解的程度是很微弱的,因此c(NH3·H2O) <<c(NH4+)。错误。
考点:考查盐的水解在溶液中离子浓度的大小比较中的应用的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案现有浓度均为0.1mol/L的MgCl2溶液、氨水溶液,按体积比1:2混合。已知Mg(OH)2的Ksp=4.0×10—12,下列说法正确的是
| A.混合前,氨水溶液中c(NH4+):c(OH—)=1:1 |
| B.混合后c(NH4+):c(Cl—)=1:1 |
| C.混合后c(Mg2+)×c(OH—)= 4.0×10—12 |
| D.向混合后的分散系中加入FeCl3溶液,白色沉淀变红褐色 |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO 和OH- 和OH- |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C.10 mL0.20mol·L-1CH3COOH溶液加入10 mL0.10mol·L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)= 0.10mol·L-1 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、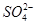 |
B.加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:Al3+、Ba2+、Cl-、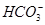 |
C.水电离产生的c(H+)=10-13mol·L-1的溶液中:Na+、Cl-、 、 、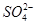 |
D.0.1 mol·L-1HNO3溶液中:Mg2+、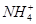 、Fe2+、Cl- 、Fe2+、Cl- |
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
如图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
| A.两条曲线间任意点均有c(H+)×c(OH-)=Kw |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
常温下,pH=12的氢氧化钠溶液pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
| A.混合前的醋酸约1%发生电离 |
| B.混合后的溶液中c(Na+)<c(CH3COO-) |
| C.氢氧化钠和醋酸和浓度不相等 |
| D.混合后的溶液呈中性 |
H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-若向H2S溶液中
H++S2-若向H2S溶液中
| A.加水,平衡向右移动,溶液中氢离子浓度增大 |
| B.通入过量SO2气体,平衡向左移动,溶液pH值增大 |
| C.滴加新制氯水,平衡向左移动,溶液pH值减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |