题目内容
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如下图所示,下列结论不正确的是 ( )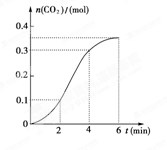
| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后又减小 |
| C.反应开始4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min间生成CO2的平均反应速率为 v (CO2)="0.1" mol·min-1 |
A
解析试题分析:A、由图可知0~2min、2~4min、4~6min时间内,生成的CO2物质的量分别是0.1mol、0.3mol-0.1mol=0.2mol、0.35mol-0.3mol=0.05mol,所以反应开始2~4min内平均反应速率最大,故A错误;B、由图可知反应速率先增大后又减小,B正确;C、随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低。由图象可知,开始生成的二氧化碳的反应速率是增大,说明反应为放热反应,即反应开始4 min内温度对反应速率的影响比浓度大,故C正确;D、反应在第2 min到第4 min间生成CO2的平均反应速率为 v (CO2)=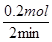 =0.1 mol·min-1,因此选项D正确,答案选A。
=0.1 mol·min-1,因此选项D正确,答案选A。
考点:考查反应速率的定量计算、外界条件对反应速率的影响以及有关图象分析等
点评:该题是中等难度的试题,主要是考查学生对反应速率含义和表示的熟悉了解程度,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于激发学生的学习兴趣和学习积极性。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O  HCO3-+OH- HCO3-+OH- |
B.FeCl3水解的离子方程式:Fe3++3H2O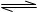 Fe (OH)3+3H+ Fe (OH)3+3H+ |
| C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1 |
| D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g)△H = 110.5kJ·mol-1 |
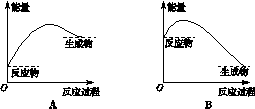
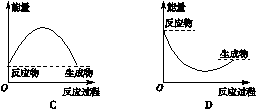
下列反应中,生成物的总能量大于反应物的总能量的是
| A.氢气在氧气中燃烧 | B.焦炭在高温下与水蒸气反应 |
| C.铝与三氧化二铁高温反应 | D.铁丝在氧气中燃烧 |
下列说法中,正确的是 ( )
| A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生,故水不加热不电离 |
| D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性 |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A.金刚石与石墨互为同位素 |
| B.石墨不如金刚石稳定 |
| C.金刚石与石墨互为同分异构体 |
| D.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
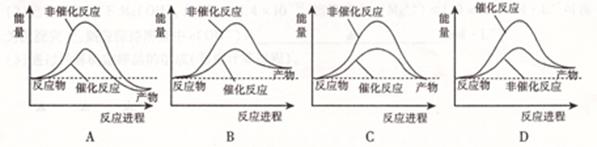
化学反应H2+Cl2===2HCl的能量变化如图所示,则下列说法正确的是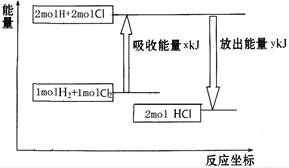
| A.该反应是放热反应 |
| B.断裂1 mol H—H键和1 mol Cl—Cl 键放出x kJ能量 |
| C.断裂1 mol H—Cl键需要吸收y kJ的能量 |
| D.2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
 2PbSO4+2H2O,充电时:阳极反应式: 用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
2PbSO4+2H2O,充电时:阳极反应式: 用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比: