题目内容
【题目】(11分)甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。回答下列问题:
(1)已知1000 K时,下列反应的平衡常数和反应热:
①CH4(g) ![]() C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1
②2CO(g) ![]() C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3
④CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) K4 ΔH4(SMR)则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
CO2(g)+4H2(g) K4 ΔH4(SMR)则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
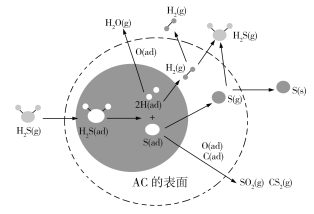
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5 ppm以下。脱硫的目的为______________。
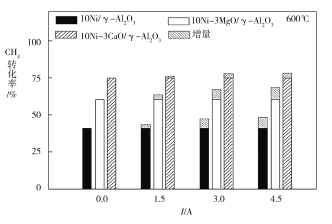
(3)下图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知ΔH4____0(填“>”或“<”)。
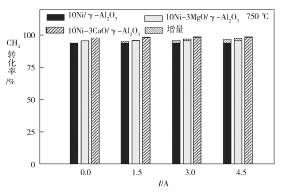
(4)下图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐____________(填“增加”“减小”或“不变”),600 ℃时,电流对三种催化剂中的____________(用图中的催化剂表示式回答)影响效果最为显著,当温度高于750 ℃时,无论电流强度大小,有无催化剂,H2产率趋于相同,其原因是______________。

(5)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2–![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
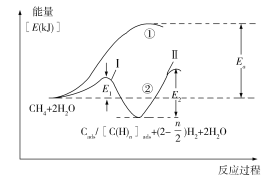
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
【答案】33.32 ΔH1+2ΔH3ΔH2 硫能使催化剂中毒(或硫能使催化剂活性下降等) > 增加 10Ni3MgO/γAl2O3 温度高于750 ℃时,几种情况下的反应均达到平衡,催化剂不改变平衡状态 = Ⅱ 第Ⅱ步的活化能大,反应速率慢
【解析】
(1)方程式CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),是由方程式①+2×③②得到,K4=
CO2(g)+4H2(g),是由方程式①+2×③②得到,K4=![]() =
=![]() =33.32,ΔH4=ΔH1+2ΔH3ΔH2。
=33.32,ΔH4=ΔH1+2ΔH3ΔH2。
(2)硫会与催化剂反应,会使催化剂中毒,因此要脱硫。
(3)由图可知电流相同时,750 ℃甲烷的转化率比600 ℃时甲烷的转化率高,说明温度越高,转化率越高,K越大,ΔH4>0。
(4)据图可知,随温度降低,H2产率的变化幅度也增大,电流对H2产率的影响作用逐渐增加;600 ℃时,10Ni3MgO/γAl2O3催化剂在不同电流时H2产率的变化幅度最大,因此电流对10Ni3MgO/γAl2O3催化剂影响最为显著;测试时间为6小时,当温度高于750 ℃时,由于反应速率加快,反应已经达平衡移动,而催化剂不影响平衡移动,因此无论电流强度大小,有无催化剂,H2产率趋于相同。
(5)同一化学反应,催化剂只能改变反应的速率,对反应热不会造成影响,故过程①和②ΔH相等。根据活化能越大,反应速率就越慢,故控制整个反应速率的是活化能较高的步骤,即控速步骤为第Ⅱ步。