题目内容
【题目】下列有关性质的比较中,不正确的是
A. 硬度由大到小:金刚石>碳化硅>晶体硅
B. 晶格能:NaBr<NaCl<MgO
C. 键的极性:N-H<O-H<F-H
D. 熔点:![]()
【答案】D
【解析】A.原子晶体中化学键键能越大、键长越短其硬度越大,这几种物质都是原子晶体,键长C-C<C-Si<Si-Si,所以硬度:金刚石>碳化硅>晶体硅,故A正确;B.晶格能与离子半径成反比,与电荷成正比,离子半径,O2-<Cl-<Br-<I-,则晶格能NaBr<NaCl<MgO,故B正确;C.元素的非金属性越强,与氢形成的化学键的极性越大,非金属性F>O>N,则键的极性:N-H<O-H<F-H,故C正确;D.因为对位形成分子间氢键增大熔点,邻位形成分子内氢键降低熔点,所以晶体熔点的高低:![]() >
>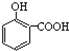 ,故D错误;答案为D。
,故D错误;答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) , ΔH=-76.0 kJ·mol-1
②3FeO(s)+H2O(g)= Fe3O4(s)+H2(g) ΔH=-18.7 kJ·mol-1
(1)在上述反应中①中,每吸收1molCO2,就有_______molFeO被氧化。
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式___________。
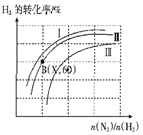
Ⅱ.一定条件下,二氧化碳转化为甲烷。向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
(3)在300℃是,将各物质按下列起始浓度(mol·L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是_____________。
选项 | CO | H2 | CH4 | H2O |
A | 0 | 0 | 1 | 2 |
B | 2 | 8 | 0 | 0 |
C | 1 | 4 | 1 | .2 |
D | 0.5 | 2 | 0.5 | 1 |
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓
度________(填字母)。
A.c(CH4)=0.8mol·L-1 B.0.8mol L-1 >c(CH4) >1.6mol L-1
C.c(CH4)=l.6mol·L-1 D.C(CH4)>1.6mol L-1
(5)在300时,如果向该容器中加入CO20.8 mol·L-1、H21.0 mol·L-1、CH4 2.8 mol·L-1、H2O 2.0mol·L-1,则该可逆反应初始速率v正_____v逆 (填“>” 或“<”)。
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H_________0(填“>”或“<”)。
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示

(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e- =C+2CO32-,则阳极的电极反应式为______________。