题目内容
某兴趣小组设计并进行了以下实验来探究Cl2、漂白粉的制备及有关性质。
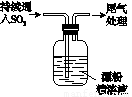
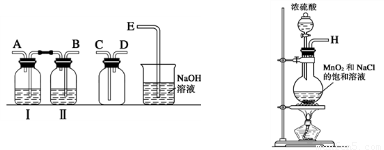
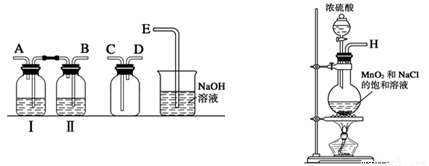
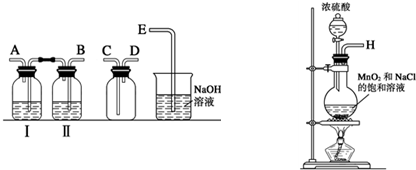
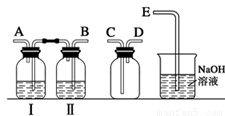
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:
H→ 、 → 、 → ;广口瓶Ⅱ中的试剂为 。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
;
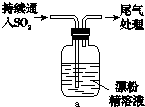
某学生设计如下实验进一步探究SO2与漂粉精的反应:
|
操作 |
现象 |
|
取4 g漂粉精固体,加入100 mL水 |
部分固体溶解,溶液略有颜色 |
|
过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
|
A |
ⅰ.液面上方出现雾状物 ⅱ.稍后,出现浑浊,溶液变为黄绿色 ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(3)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀。
实验a的目的是 。
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应。请设计实验方案,进一步确认这种可能性,方案为
。
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因: 。检验褪色后溶液中是否有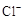 的方法是:
。
的方法是:
。
(1) BACDE (1分);饱和食盐水(1分)
(2)2Ca(OH)2 +2 Cl2 →Ca(ClO)2 +CaCl2 +2H2O (2分)
(3)碱性、漂白性 (2分)
(4)排除氯气干扰(1分,合理给分)
(5)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色(1分,合理给分)
(6)SO2 +Cl2 +2H2O → H2SO4 +2HCl (2分);取样,加入足量的硝酸钡,带沉淀沉积后,取上层清夜,滴入硝酸银与稀硝酸,产生白色沉淀,说明有Cl—。(2分)
【解析】
试题分析:(1)制备氯气的实验中,要除去杂质氯化氢和水蒸汽,所以用到洗气装置,一般是长进短出,因此顺序为:B A C D E,又因为是先除去混合气中的氯化氢,因此广口瓶Ⅱ中的试剂为饱和食盐水,(氯气在饱和食盐水的溶解度较小)。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:2Ca(OH)2 +2 Cl2 →Ca(ClO)2 +CaCl2 +2H2O 。
(3)pH试纸颜色先变蓝说明呈碱性,后褪色说明漂粉精有漂白性。
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:a.用湿润的碘化钾淀粉试纸检验雾状物,无变化目的是排除氯气干扰。
(5)现象ⅱ中溶液变为黄绿色说明有氯气生成,实质是次氯酸根,氯离子在酸性溶液中发生了反应。只要采用不含氯离子的溶液可以进行验证即可,方案为向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色。
(6)ⅲ中黄绿色褪去的原是二氧化硫具有还原性和氯气发生氧化还原反应,SO2 +Cl2 +2H2O → H2SO4 +2HCl。检验褪色后溶液中是否有氯离子的方法是取样,加入足量的硝酸钡,带沉淀沉积后,取上层清夜,滴入硝酸银与稀硝酸,产生白色沉淀,说明有Cl—。
考点:Cl2、漂白粉的制备及有关性质。

(1)实验室拟用如图装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
(3)某学生设计如表实验进一步探究SO2与漂粉精的反应,则漂白粉具有
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 |
ⅰ.液面上方出现雾状物 ⅱ.稍后,出现浑浊,溶液变为黄绿色 ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应.请设计实验方案,进一步确认这种可能性,方案为
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因
为探究Cl2、漂白粉的制备及有关性质,某兴趣小组设计并进行了以下实验探究。请回答以下问题:
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→_______、_______→_______、_______→_______;其中广口瓶Ⅱ中的试剂为_______。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式_______;
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2。请设计实验,探究该样品中除CaCl2外还含有的其他固体物质。
①提出合理假设。
假设1:该漂白粉未变质,还含有Ca(ClO)2
假设2:该漂白粉全部变质,还含有______;
假设3:该漂白粉部分变质,还含有Ca(ClO)2和CaCO3。
②设计实验方案,进行实验。请在下表中写出实验步骤、预期现象和结论。
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1 mol·L-1 HCl溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-。)
|
|
实验步骤 |
预期现象与结论 |
|
步骤1 |
取少量上述漂白粉于试管中,先加入 溶解后,再把生成的气体通入 。 |
若 ,则假设1成立; 若 ,则假设2或假设3成立。 |
|
步骤2 |
已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1 mol·L-1 HCl溶液,再加入 。 |
若 ,则假设2成立; 若 ,则假设3成立。 |