题目内容
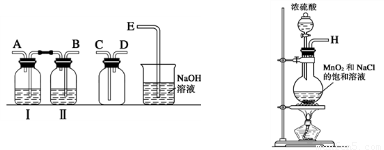
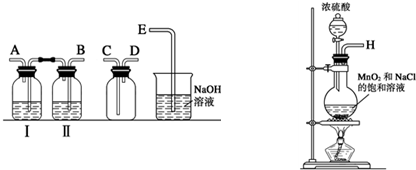
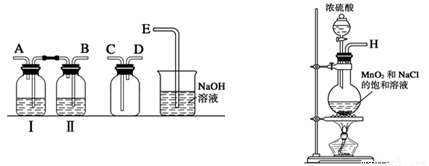
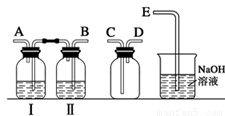
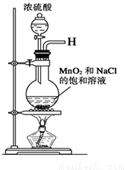
某兴趣小组设计并进行了以下实验来探究Cl2、漂白粉的制备及有关性质.(1)实验室拟用如图装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
(3)某学生设计如表实验进一步探究SO2与漂粉精的反应,则漂白粉具有
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
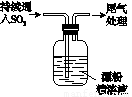
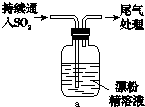 |
ⅰ.液面上方出现雾状物 ⅱ.稍后,出现浑浊,溶液变为黄绿色 ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应.请设计实验方案,进一步确认这种可能性,方案为
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(3)根据所测pH的大小及试纸先变蓝后褪色的现象推出漂白粉的性质;
(4)检验盐酸要排除氯气的干扰;
(5)依据次氯酸根离子和氯离子在酸溶液中会发生归中反应生成氯气,向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(6)二氧化硫继续通入后和生成的氯气发生反应生成硫酸和盐酸;检验氯离子要先排除硫酸根离子的干扰,可用硝酸钡和硫酸根离子沉淀,取清液用硝酸银检验氯离子.
故答案为:B;A;C;D;E;饱和食盐水;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)测得pH约为12,说明漂白粉显碱性,试纸先变蓝后褪色,说明漂白粉具有漂白性,故答案为:碱性、漂白性;
(4)因氯气与酸化的AgNO3溶液反应也产生白色沉淀,故检验盐酸,应先排除氯气的干扰,故答案为:排除氯气干扰;
(5)现象ⅱ中溶液变为黄绿色的可能原因:向漂白精溶液中逐滴滴入硫酸,随溶液酸性的增强,漂白精中成分为次氯酸钙、氯化钙,次氯酸根具有强氧化性在酸性溶液中可以氧化氯离子为氯气,氯气为黄绿色气体,氯气溶于水呈黄绿色,
故答案为:向漂白精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
(6)溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸;反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;由于反应产生了硫酸,故要检验氯离子,须先排除硫酸根的干扰,可用硝酸钡溶液,生成硫酸钡沉淀,取上层清液,再加硝酸银,产生白色沉淀,证明有氯离子,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;取样,加入足量的硝酸钡,带沉淀沉积后,取上层清夜,滴入硝酸银与稀硝酸,产生白色沉淀,说明有Cl-.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案某兴趣小组设计并进行了以下实验来探究Cl2、漂白粉的制备及有关性质。
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:
H→ 、 → 、 → ;广口瓶Ⅱ中的试剂为 。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
;
某学生设计如下实验进一步探究SO2与漂粉精的反应:
|
操作 |
现象 |
|
取4 g漂粉精固体,加入100 mL水 |
部分固体溶解,溶液略有颜色 |
|
过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
|
A |
ⅰ.液面上方出现雾状物 ⅱ.稍后,出现浑浊,溶液变为黄绿色 ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(3)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀。
实验a的目的是 。
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应。请设计实验方案,进一步确认这种可能性,方案为
。
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因: 。检验褪色后溶液中是否有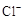 的方法是:
。
的方法是:
。
为探究Cl2、漂白粉的制备及有关性质,某兴趣小组设计并进行了以下实验探究。请回答以下问题:
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→_______、_______→_______、_______→_______;其中广口瓶Ⅱ中的试剂为_______。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式_______;
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2。请设计实验,探究该样品中除CaCl2外还含有的其他固体物质。
①提出合理假设。
假设1:该漂白粉未变质,还含有Ca(ClO)2
假设2:该漂白粉全部变质,还含有______;
假设3:该漂白粉部分变质,还含有Ca(ClO)2和CaCO3。
②设计实验方案,进行实验。请在下表中写出实验步骤、预期现象和结论。
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1 mol·L-1 HCl溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-。)
|
|
实验步骤 |
预期现象与结论 |
|
步骤1 |
取少量上述漂白粉于试管中,先加入 溶解后,再把生成的气体通入 。 |
若 ,则假设1成立; 若 ,则假设2或假设3成立。 |
|
步骤2 |
已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1 mol·L-1 HCl溶液,再加入 。 |
若 ,则假设2成立; 若 ,则假设3成立。 |