题目内容
硫酸钠-过氧化氢-氯化钠加合物(xNaSO4·yH2O2·zNaCl)又称固体双氧水,是一种新型精细化工产品,具有漂白、杀菌、消毒等作用。为探究该加合物的组成,某化学兴趣小组设计并进行了如下实验:
第一步:准确称取6.945g样品,配制成250.00ml无色溶液A
第二步:准确量取25.00ml溶液A于锥形瓶中,加适量稀硫酸酸化后,用0.0400mol/LKMnO4标准溶液滴定至终点,消耗溶液KMnO420.00ml
第三步:另取25.00ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.932g.
请回答下列问题:
(1)欲配制无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有 。
(2)配平下列离子方程式______MnO4-+_____H2O2+_________=______Mn2++_____O2↑+______。
(3)滴定前,KMnO4标准溶液应盛装于中 (填仪器名称),滴定终点现象为 。
(4)第三步能否通过加入AgNO3溶液的方法来测定?为什么
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则Y值______________(填“偏
高 偏低 无影响”)
(6)通过计算确定样品的组成为 。
(1)烧杯、250 mL容量瓶(2分) (2)2,5,6H+,2,5,8H2O(2分)
(3)酸式滴定管(1分)
当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色(2分)
(4)不能(1分) 加入AgNO3溶液使Cl-完全沉淀的同时,要生成Ag2SO4微溶物,会使最终测定结果中z值偏高(2分) (5)偏高(2分) (6)4Na2SO4・2H2O2・NaCl(4分)
【解析】
试题分析:(1)欲配制250.00ml无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有溶解时需要的烧杯以及250ml容量瓶。
(2)高锰酸钾加压强氧化性,在反应中Mn元素的化合价从+7价降低到+2价,得到5个电子。双氧水中氧元素的化合价从-1价升高到0价,失去1个电子。根据电子的得失守恒可知氧化剂高锰酸钾与还原剂双氧水的物质的量之比是2:5。反应在酸性条件下进行,因此反应物还有氢离子参加。又因为原子是守恒的,所以还应该有水生成,因此配平后的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.。
(3)酸性高锰酸钾溶液具有强氧化性和酸性,因此滴定前,KMnO4标准溶液应盛装于中酸式滴定管中。由于酸性高锰酸钾溶液显紫红色,所以滴定终点现象为当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色。
(4)根据物质的组成可知,加入AgNO3溶液使Cl-完全沉淀的同时,会生成Ag2SO4微溶物,从而使最终测定结果中z值偏高,所以不能用硝酸银溶液代替。
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则导致酸性高锰酸钾溶液的浓度减小,因此再滴定双氧水时,消耗高锰酸钾溶液的体积增加,从而导致Y值偏高。
(6)25.00ml溶液A消耗高锰酸钾溶液的体积是20.00ml,则250ml溶液A消耗高锰酸钾溶液的体积是200.00ml,则高锰酸钾的物质的量=0.2L×0.0400mol/L=0.00800ml。所以根据反应的方程式可知,消耗双氧水的物质的量=(0.00800mol÷2)×5=0.0200mol。25.00ml溶液A得到白色沉淀0.932g,该固体是硫酸钡,物质的量=0.932g÷233g/mol=0.004mol。所以250.00ml溶液A生成白色沉淀的物质的量是0.04mol,即硫酸钠的物质的量是0.04mol。因此6.945g样品中氯化钠的物质的量=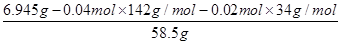 =0.01mol,则x:y:z=0.04:0.02:0.01=4:2:1,因此化学式为4Na2SO4・2H2O2・NaCl。
=0.01mol,则x:y:z=0.04:0.02:0.01=4:2:1,因此化学式为4Na2SO4・2H2O2・NaCl。
考点:考查一定物质的量浓度的配制;氧化还原反应的配平和有关计算;氧化还原滴定仪器选择、误差分析以及物质组成的有关计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案