题目内容
【题目】可逆反应A(g)+2B(g)![]() 2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”“减小”或“不变”)填入空格。
(1)升高温度,B的转化率________,v(正)________,v(逆)________。
(2)加正催化剂,A的物质的量____________,v(正)________,v(逆)________。
(3)保持温度和压强不变,加入稀有气体,则C的物质的量________,A的转化率________。
(4)保持温度和体积不变,加入稀有气体,A的转化率________。
(5)若温度和体积不变,反应从开始到平衡,容器内气体的密度________,压强________。
【答案】减小增大增大不变增大增大减小减小不变不变减小
【解析】
(1)升高温度,平衡逆向移动,B的转化率减小,正逆反应速率都增大;因此本题答案是:减小,增大 ,增大。
(2)加入正催化剂,平衡不移动,正逆反应速率都增大,A的物质的量不变;因此本题答案是:不变,增大 ,增大。
(3)保持温度和压强不变,加入稀有气体,等效于减压,则平衡逆向移动,则C的物质的量减小,A的转化率减小,因此本题答案是:减小,减小。
(4)保持温度和体积不变,加入稀有气体,每种物质的浓度不变,平衡不移动,A的转化率不变;因此本题答案是:不变。
(5)温度和体积不变,反应物和生成物都为气体,反应前后气体质量不变,则密度不变,而气体的物质的量减小,所以压强减小;综上所述,本题答案是:不变,减小。

【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
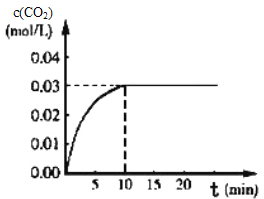
(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度
C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2)=c(H2)= 0.13mol/L,则此时正、逆反应速率的大小:υ正______________υ逆(填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)Pb(s)+C02(g) △H,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
(5)该反应的△H______________0(选填“>”、“〈”或“=”)。
(6)当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______________(填“增大”、“减小”或“不变”)。