题目内容
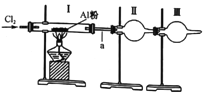
【题目】有一包白色粉末可能含硫酸钡、碳酸钠、和氢氧化钡中的一种或几种,取一定量的该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到有白色不溶物。
小张同学认为,白色粉末中一定含有硫酸钡;
小李同学认为,小张同学的结论不准确,其理由可用化学方程式表示为______________。
针对上述两名同学的观点,小刘同学进一步设计如下实验方案进行探究:

(1)步骤③中,滴入酚酞溶液后,若滤液E为红色,则滤液E中除酚酞外还一定含有的溶质是_______(填化学式,下同),由此得出原白色粉末成分组成的结论是______________。
(2)小王同学认为,只需要取少量滤渣B,加入过量的稀盐酸,若看到的现象是白色不溶物部分溶解,且有气泡产生,就足以说明原白色粉末的成分是__________________。
【答案】Na2CO3 + Ba(OH)2 ==== BaCO3 ↓ + 2NaOHNaOH NaCl BaCl2BaSO4 Na2CO3 Ba(OH)2 或 Na2CO3 Ba(OH)2BaSO4 Na2CO3 Ba(OH)2
【解析】
(1)碳酸钠和氢氧化钡反应会生成碳酸钡沉淀和和氢氧化钠,化学方程式为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,则答案为:Na2CO3 + Ba(OH)2 ==== BaCO3 ↓ + 2NaOH;(2)向烧杯中的溶液中加入几滴酚酞试液,若溶液变红,就可证明其中含有氢氧化钠,同是原粉末中含有氢氧化钡,而在步骤②中加入过量的氯化钡有沉淀生成,故原粉末中一定含有碳酸钠,故答案为:NaOH、NaCl、BaCl2 ;BaSO4、Na2CO3、Ba(OH)2 或 Na2CO3、Ba(OH)2 ; (3)加入过量的稀盐酸,沉淀部分溶解,说明一定含有硫酸钡,而碳酸钠和氢氧化钡是一定含有的,故答案为:BaSO4、Na2CO3、Ba(OH)2。

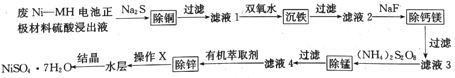
【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
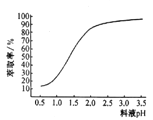
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
③“操作X”的名称是________________。