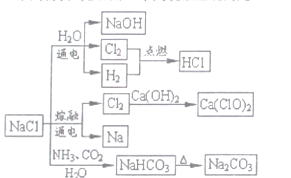
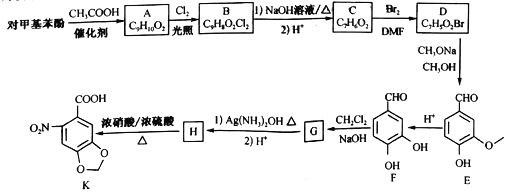
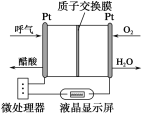
题目内容
【题目】利用实验室常用的物品,根据电化学原理,可以设计原电池。请填写下列空白:
(1)实验原理:Fe+2H+= 。
(2)实验用品:电极( 、 )(填所用电极的名称)、稀硫酸、烧杯、导线、耳机(或电流计)。
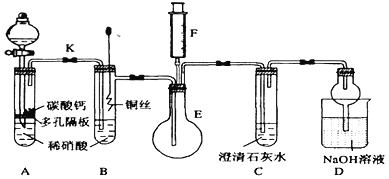
(3)实验装置如图所示。
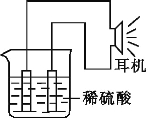
(4)原电池工作原理分析:
该原电池工作时,负极为 (填化学式),发生 (填“氧化”或“还原”),其电极反应式为 ,另一电极为正极,发生 反应,其电极反应式为 ,外电路中电子流动方向为 。
【答案】(1)Fe2++H2↑
(2)铁钉(或铁片、铁丝等合理答案);铜丝(或其他合理答案)
(4)Fe;氧化;Fe-2e-=Fe2+;还原;2H++2e-=H2↑;Fe→耳机→Cu(或其他合理答案)
【解析】(1)从反应物可知,设计该原电池是基于Fe与H+之间发生的氧化还原反应,生成物为Fe2+和H2。(2)铁失电子被氧化,所以铁作负极,正极可以是比铁不活泼的金属如铜、铂等,也可以是碳棒。(4)该电池工作时负极发生氧化反应:Fe-2e-=Fe2+,正极发生还原反应:2H++2e-=H2↑,外电路中电子从负极流出,经过导线、耳机,流向正极。

练习册系列答案
相关题目