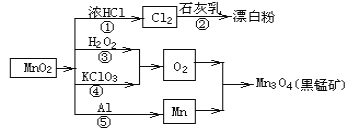
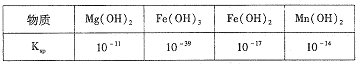��Ŀ����
����Ŀ�����Σ�3PbO��PbSO4��H2O��������������ϩ�����ȶ�����200�����Ͽ�ʼʧȥ�ᾧˮ��������ˮ���л��ܼ�����200.0tǦ�ࣨ��Ҫ�ɷ�ΪPbO��Pb��PbSO4�ȣ�Ϊԭ���Ʊ����εĹ���������ͼ��ʾ��
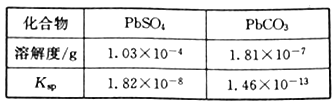
��֪��PbSO4��PbCO3���ܽ�Ⱥ��ܶȻ�Ksp���±���
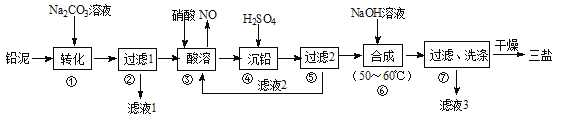
��1��������ת����Ŀ����_______����Һ1�е�����ΪNa2CO3��_______���ѧʽ����
��2������������ʱ��Ϊ����������ʣ��ɲ�ȡ�Ĵ�ʩ��_________����дһ����������Ǧ�����ᷴӦ����Pb(NO3)2��NO�����ӷ���ʽΪ__________________��
��3����Һ2�п�ѭ�����õ����ʵĻ�ѧʽΪ_______������������Ǧ�����Һ��c(Pb2+)=1.82��10-5mol/L�����ʱc(SO42-)=______mol/L��
��4��������ϴ�Ӳ���ʱ����������Ƿ�ϴ����ȫ�ķ�����________________��
��5���������ϳ����εĻ�ѧ����ʽΪ____________�����õ��������������99.Ot������Ǧ���е�ǦԪ����80��ת��Ϊ���Σ���Ǧ����ǦԪ�ص���������Ϊ________��
���𰸡���1�� ��PbSO4ת��ΪPbCO3�����Ǧ�������� Na2SO4 ��2�� �ʵ����£����ʵ���������Ũ�Ȼ��С�������������������𰸣� 3Pb+8H++2NO3-=3Pb2++2NO��+4H2O HNO3 ��3��1.00��10-3 ��4��ȡ�������һ�ε�ϴ��Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ�������������𰸣� ��5�� 4PbSO4+6NaOH![]() 3Na2SO4+3PbO��H2O+2H2O 51.75%
3Na2SO4+3PbO��H2O+2H2O 51.75%
����������Ǧ���м���Na2CO3��Һ��PbSO4ת��Ϊ����PbCO3�����ӷ���ʽΪCO32-+PbSO4=PbCO3+SO42-��Ȼ����˵õ���Һ1ΪNa2SO4��Һ���������м����������ܣ�PbO��Pb��PbCO3�������ᷴӦ����Pb��NO3��2��Pb�����ᷴӦ������NO��Ǧ����������Pb��NO3��2��NO�����ӷ���ʽΪ3Pb+8H++2NO3-=3Pb+2NO��+4H2O��Ȼ������Һ�м������ᣬ����bSO4���������ˣ���Һ2����Ҫ�ɷ���HNO3���������м���NaOH��Һ��������Ӧ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O������ϴ�Ӹ���õ�3PbOPbSO4H2O����Һ3�к���Na2SO4��
��1���������ô�����Һ����Ǧ�࣬��PbSO4ת��ΪPbCO3�����Ǧ�������ʣ���Һ1�е�����Ϊ������Na2CO3�ͷ�Ӧ���ɵ�Na2SO4��
��2������������ʱ������ͨ���ʵ����¡��ʵ���������Ũ�Ȼ��С��������������������ʣ�ͨ�����Ϸ���֪�������ӷ�Ӧ����ʽΪ3Pb+8H++2NO3-=3Pb2++2NO��+4H2O��
��3����Һ2�п�ѭ�����õ����ʵĻ�ѧʽΪHNO3 ������Ksp��PbSO4��=1.82��10-8=c(Pb2+)��c(SO42-)��c(Pb2+)=1.82��10-5mol/L�����ʱc(SO42-)=1.00��10-3mol/L��
��4���ó�����������������������ӣ��������ữ���Ȼ������飬����鷽��Ϊȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ��
��5���������ϳ����εĻ�ѧ����ʽΪ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O�����õ��������������99.0t�����е�ǦԪ������Ϊ99.0t��![]() ��100%=82.8t����Ǧ����ǦԪ�ص���������Ϊ
��100%=82.8t����Ǧ����ǦԪ�ص���������Ϊ![]() =51.75%��
=51.75%��