题目内容
【题目】(1)下列说法不正确的是_________
A.H、D、T表示同一种核素
B.甲烷与正丁烷(CH3CH2CH2CH3)互为同系物
C.金刚石和石墨互为同素异形体
D.乙醇(CH3CH2OH)与二甲醚(CH3-O-CH3)互为同分异构体
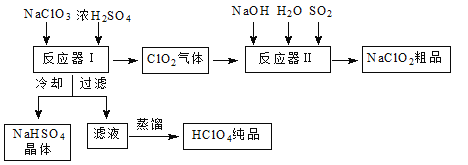
(2)金刚石和石墨燃烧,氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨中________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH为________。
②120 g石墨在一定量空气中燃烧,生成气体360g,该过程放出的热量________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1。
NO分子中化学键的键能为________kJ·mol-1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式_______________________。
【答案】A 石墨 -393.5 kJ·mol-1 2520kJ 631.5 2NO(g)+2CO(g)===N2(g)+2CO2(g)ΔH=-746.0 kJ·mol-1
【解析】
(1)A、具有一定数目的中子和质子的原子称为一种核素;结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;由同种元素形成的不同种单质互为同素异形体;分子式相同结构式不同的化合物互为同分异构体;
(2)①物质的能量越低越稳定;根据图像可计算石墨完全燃烧生成二氧化碳放出的热量;
②依据石墨和生成气体的质量列方程式计算得一氧化碳和二氧化碳的物质的量,再依据热化学方程式计算反应放出的热量;
(3)依据反应热△H=反应物的总键能-生成物的总键能计算;
(4)由图像得到一氧化碳与氧气反应的热化学方程式,再依据盖斯定律计算。
(1)A、具有一定数目的中子和质子的原子称为一种核素,H、D、T是三种不同的核素,故错误;
B、结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,甲烷与正丁烷(CH3CH2CH2CH3)都是烷烃,互为同系物,故正确;
C、由同种元素形成的不同种单质互为同素异形体,金刚石和石墨是碳元素的不同单质,互为同素异形体,故正确;
D、分子式相同结构式不同的化合物互为同分异构体,乙醇(CH3CH2OH)与二甲醚(CH3-O-CH3)的分子式相同,结构不同,互为同分异构体,故正确;
A错误,故答案为:A;
(2)①物质的能量越低越稳定,由图可知金刚石能量比石墨高,则通常状况下石墨更稳定;根据图像可知石墨完全燃烧生成二氧化碳放出的热量为110.5kJ+283.0kJ=393.5kJ,则表示石墨燃烧热的热化学方程式为C(石墨s)+O2(g)=CO2(g)△H=-393.5kJ/mol,故答案为:石墨;-393.5 kJ·mol-1;
②120 g石墨的物质的量为![]() =10mol,设生成一氧化碳xmol,则二氧化碳为(10-x)mol,由生成生成气体360g可得关系式28x+44(10-x)=360,解得x=5mol,则该过程放出的热量(110.5+393.5)kJ/mol×5mol=2520kJ,故答案为:2520kJ;
=10mol,设生成一氧化碳xmol,则二氧化碳为(10-x)mol,由生成生成气体360g可得关系式28x+44(10-x)=360,解得x=5mol,则该过程放出的热量(110.5+393.5)kJ/mol×5mol=2520kJ,故答案为:2520kJ;
(3)设NO分子中化学键的键能为x,依据反应热△H=反应物的总键能-生成物的总键能可得关系式946 kJ/mol+497kJ/mol-2x=+180 kJ/mol,解得x=631.5 kJ/mol,故答案为:631.5;
(4)由图像可知一氧化碳与氧气反应的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol①,氮气与氧气反应的热化学方程式为N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol,根据盖斯定律,①-②得到2NO(g)+2CO(g)=N2(g)+2CO2(g),则ΔH=ΔH1—ΔH2=-566kJ/mol-180kJ/mol=-746.0 kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g),则ΔH=-746.0 kJ/mol。

 阅读快车系列答案
阅读快车系列答案