题目内容
已知温度越高,AgI在水中的溶解度越大,现向有AgI固体的AgI饱和溶液中分别进行如下操作,有关离子浓度的变化情况是:(1)若加入少量水,则c(I-)______(填“增大”、“减小”或“不变”)
(2)若加入AgNO3固体,则AgI在水中的溶解度______(填“增大”、“减小”或“不变”)
(3)若加入NaCl固体,则AgI的溶度积Ksp______(填“增大”、“减小”或“不变”)
(4)若某温度下,AgI的溶度积Ksp=9.0×10-20,则AgI在该温度下的溶解度是______g.
【答案】分析:在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,平衡状态下存在溶度积常数,依据平衡影响因素分析平衡的变化;
(1)若加入少量水,固体溶解,最终形成饱和溶液;
(2)若加入AgNO3固体,会增加银离子浓度,沉淀溶解平衡逆向移动;
(3)若加入NaCl固体,会减少银离子浓度,沉淀溶解平衡正向移动;
(4)先根据AgI的溶度积Ksp=9.0×10-20,求出银离子的浓度,设溶液的体积为1L,求出溶解的AgI的质量,然后根据 =
=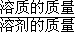 求出AgI在该温度下的溶解度.
求出AgI在该温度下的溶解度.
解答:解:在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,AgI(s)?Ag+(aq)+I-(aq),平衡状态下存在溶度积常数,Ksp=C(Ag+)?C(I-);
(1)若加入少量水,固体溶解,最终形成饱和溶液,故银离子浓度不变,故答案为:不变;
(2)若加入AgNO3固体,会增加银离子浓度,沉淀溶解平衡逆向移动,c(I-)减小,故答案为:减小;
(3)若加入NaCl固体,会减少银离子浓度,沉淀溶解平衡正向移动,c(I-)增大,但溶度积Ksp不变;故答案为:不变;
(4)AgI的溶度积Ksp=9.0×10-20,则C(Ag+)=3×10-10mol/L,设溶液的体积为1L,n(AgI)=n(Ag+)=3×10-10mol/L×1L=3×10-10mol,溶解的AgI的质量为3×10-10mol×235g/mol=7.05×10-8g,溶液的质量为:1000ml×1g?mL-1=1000g,水的质量为1000g-7.05×10-8g=1000g,AgI在该温度下的溶解度是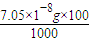 =7.05×10-9g,故答案为:7.05×10-9.
=7.05×10-9g,故答案为:7.05×10-9.
点评:本题主要考查了外界条件对溶解平衡的影响以及溶解度的计算,难度中等,要注意溶度积与溶解度的换算.
(1)若加入少量水,固体溶解,最终形成饱和溶液;
(2)若加入AgNO3固体,会增加银离子浓度,沉淀溶解平衡逆向移动;
(3)若加入NaCl固体,会减少银离子浓度,沉淀溶解平衡正向移动;
(4)先根据AgI的溶度积Ksp=9.0×10-20,求出银离子的浓度,设溶液的体积为1L,求出溶解的AgI的质量,然后根据
 =
=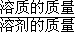 求出AgI在该温度下的溶解度.
求出AgI在该温度下的溶解度.解答:解:在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,AgI(s)?Ag+(aq)+I-(aq),平衡状态下存在溶度积常数,Ksp=C(Ag+)?C(I-);
(1)若加入少量水,固体溶解,最终形成饱和溶液,故银离子浓度不变,故答案为:不变;
(2)若加入AgNO3固体,会增加银离子浓度,沉淀溶解平衡逆向移动,c(I-)减小,故答案为:减小;
(3)若加入NaCl固体,会减少银离子浓度,沉淀溶解平衡正向移动,c(I-)增大,但溶度积Ksp不变;故答案为:不变;
(4)AgI的溶度积Ksp=9.0×10-20,则C(Ag+)=3×10-10mol/L,设溶液的体积为1L,n(AgI)=n(Ag+)=3×10-10mol/L×1L=3×10-10mol,溶解的AgI的质量为3×10-10mol×235g/mol=7.05×10-8g,溶液的质量为:1000ml×1g?mL-1=1000g,水的质量为1000g-7.05×10-8g=1000g,AgI在该温度下的溶解度是
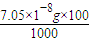 =7.05×10-9g,故答案为:7.05×10-9.
=7.05×10-9g,故答案为:7.05×10-9.点评:本题主要考查了外界条件对溶解平衡的影响以及溶解度的计算,难度中等,要注意溶度积与溶解度的换算.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 (2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.

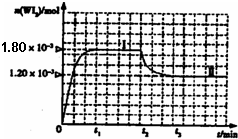
 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
