题目内容
 (2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.(1)氯元素的原子结构示意图为


(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物.制备ClO2的方法有以下两种:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O…①
2NaClO2+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O …②
你认为哪种方法最佳
②
②
(填序号),理由是ClO2中混有O2,不会产生对人体有害的物质
ClO2中混有O2,不会产生对人体有害的物质
.(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
2C1-+2H2O
Cl2↑+H2↑+2OH-
| ||
2C1-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
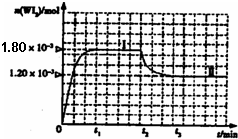
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点.一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)
的密闭容器中,加热使其反应.如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1.则:
①该反应的△H
小于
小于
0(填“大于”或“等于”或“小于”)②从反应开始到t1时间内的平均反应速率v(I2)=
| 0.036 |
| t1 |
| 0.036 |
| t1 |
③下列说法中不正确的是
A
A
(填序号).A.该反应的平衡常数表达式是K=
| [WI2] |
| [W][I2] |
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是
AgI
AgI
,溶液中离子浓度由大到小的顺序是c(K+)>c(NO-3)>c(Cl-)>c(Ag+)>c(I-)
c(K+)>c(NO-3)>c(Cl-)>c(Ag+)>c(I-)
[不考虑H+和OH-.25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17].(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ/mol
②Ti(s)+2Cl2(g)=TiCl4(l)△H=-770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式
2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)△H=-512kJ?mol-1
2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)△H=-512kJ?mol-1
.分析:(1)原子核外电子数等于核内质子数;
(2)根据反应的产物是否有毒性和具有污染性等角度考虑;
(3)电解饱和食盐水可以获得重要的化工原料氯气以及氢气和氢氧化钠;
(4)①根据温度对化学平衡的影响规律来分析;
②根据公式v=
来计算反应速率;
③化学平衡常数=
;
(5)越是难溶的沉淀越容易生成,根据溶液中离子浓度大小的比较方法来比较离子浓度;
(6)根据盖斯定律来计算反应的焓变,书写热化学方程式.
(2)根据反应的产物是否有毒性和具有污染性等角度考虑;
(3)电解饱和食盐水可以获得重要的化工原料氯气以及氢气和氢氧化钠;
(4)①根据温度对化学平衡的影响规律来分析;
②根据公式v=
| △c |
| △t |
③化学平衡常数=
| 生成物浓度系数次方的乘积 |
| 反应物浓度系数次方的乘积 |
(5)越是难溶的沉淀越容易生成,根据溶液中离子浓度大小的比较方法来比较离子浓度;
(6)根据盖斯定律来计算反应的焓变,书写热化学方程式.
解答:解:(1)氯原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)根据反应方程式,方法①制备ClO2的产物氯气有毒,对空气会造成污染,而方法②生成的氧气是不会造成污染的,故答案为:②;ClO2中混有O2,不会产生对人体有害的物质;
(3)电解饱和食盐水的原理方程式为:2C1-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2C1-+2H2O
Cl2↑+H2↑+2OH-;
(4)①根据图示,温度越高,WI2(g)的物质的量反而越小,即平衡向左进行,而升高温度,化学平衡向着吸热方向进行,所以逆向是吸热方向,正向是放热的,故△H小于0,
故答案为:小于;
②从反应开始到t1时间内,结合图象,生成WI2(g)的物质的量为1.8×10-3mol,所以碘单质的物质的量减少1.8×10-3mol,根据公式v=
=
=
mol?L-1?min-1,故答案为:
mol?L-1?min-1;
③A、化学平衡常数=
,但是固体单质W不列入表达式中,故A错误;
B、灯丝附近温度越高,化学平衡越向着吸热方向即逆向进行,灯丝附近区域WI2越易变为W而重新沉积到灯丝上,故B正确;
C、利用该反应原理可以提纯钨,故C正确;
故答案为:A;
(5)碘化银的溶度积最小,越容易生成,溶液混合反应之后,溶液的组成为:含有0.001mol的钾离子,0.0006mol的硝酸根离子,以及0.0004mol的氯离子,碘化银沉淀生成,碘离子全沉淀,氯化银沉淀也产生,均为0.0005mol但是绿化赢得电离程度大,故答案为:AgI; c(K+)>c(NO-3)>c(Cl-)>c(Ag+)>c(I-);
(6)根据盖斯定律来计算反应的焓变,目标反应=①×2-②,即热化学方程式为:2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)△H=-512kJ?mol-1,
故答案为:2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)△H=-512kJ?mol-1.
 ,故答案为:
,故答案为: ;
;(2)根据反应方程式,方法①制备ClO2的产物氯气有毒,对空气会造成污染,而方法②生成的氧气是不会造成污染的,故答案为:②;ClO2中混有O2,不会产生对人体有害的物质;
(3)电解饱和食盐水的原理方程式为:2C1-+2H2O
| ||
| ||
(4)①根据图示,温度越高,WI2(g)的物质的量反而越小,即平衡向左进行,而升高温度,化学平衡向着吸热方向进行,所以逆向是吸热方向,正向是放热的,故△H小于0,
故答案为:小于;
②从反应开始到t1时间内,结合图象,生成WI2(g)的物质的量为1.8×10-3mol,所以碘单质的物质的量减少1.8×10-3mol,根据公式v=
| △c |
| △t |
| ||
| t1min |
| 0.036 |
| t1 |
| 0.036 |
| t1 |
③A、化学平衡常数=
| 生成物浓度系数次方的乘积 |
| 反应物浓度系数次方的乘积 |
B、灯丝附近温度越高,化学平衡越向着吸热方向即逆向进行,灯丝附近区域WI2越易变为W而重新沉积到灯丝上,故B正确;
C、利用该反应原理可以提纯钨,故C正确;
故答案为:A;
(5)碘化银的溶度积最小,越容易生成,溶液混合反应之后,溶液的组成为:含有0.001mol的钾离子,0.0006mol的硝酸根离子,以及0.0004mol的氯离子,碘化银沉淀生成,碘离子全沉淀,氯化银沉淀也产生,均为0.0005mol但是绿化赢得电离程度大,故答案为:AgI; c(K+)>c(NO-3)>c(Cl-)>c(Ag+)>c(I-);
(6)根据盖斯定律来计算反应的焓变,目标反应=①×2-②,即热化学方程式为:2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)△H=-512kJ?mol-1,
故答案为:2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)△H=-512kJ?mol-1.
点评:本题是一道综合性较强的题目,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目