题目内容
现有部分短周期元素的性质或原子结构如下表:
完成下列问题:
(1)元素T在周期表中位于第
(2)T、X、Y、Z、M原子半径由大到小的顺序是
(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是
 .
.
(4)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是
(6)右图为元素X与Z形成的化合物分子XZ2的晶胞结构,在该晶胞中,离每一个XZ2最近的XZ2有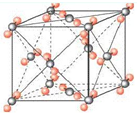
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 原子最外层电子数是次外层的三倍 |
| M | 与X、Y、Z既能形成10电子分子又能形成18电子分子 |
(1)元素T在周期表中位于第
3
3
周期第16
16
纵行.(2)T、X、Y、Z、M原子半径由大到小的顺序是
S>C>N>O>H
S>C>N>O>H
.(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是


(4)元素Z与元素T相比,非金属性较强的是
O
O
(用元素符号表示),下列表述中能证明这bd
bd
.a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
,已知该盐溶液的pH值为5,则该盐溶液中水电离出的氢离子浓度为10-5mol/L
10-5mol/L
.(6)右图为元素X与Z形成的化合物分子XZ2的晶胞结构,在该晶胞中,离每一个XZ2最近的XZ2有
12
12
个,若
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为
4M/(a3NA)
4M/(a3NA)
g/cm3.(写出表达式)分析:T元素M层上的电子数是原子核外电子层数的2倍,为S元素;
X元素最外层电子数是次外层电子数的2倍,应为C元素;
Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,应为N元素;
Z元素原子最外层电子数是次外层的三倍,应为O元素;
M元素与X、Y、Z既能形成10电子分子又能形成18电子分子,应为H元素,
根据元素结构、性质的递变规律判断原子半径、非金属性强弱,利用盐类水解原理比较离子浓度大小顺序,运用均摊发计算晶胞.
X元素最外层电子数是次外层电子数的2倍,应为C元素;
Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,应为N元素;
Z元素原子最外层电子数是次外层的三倍,应为O元素;
M元素与X、Y、Z既能形成10电子分子又能形成18电子分子,应为H元素,
根据元素结构、性质的递变规律判断原子半径、非金属性强弱,利用盐类水解原理比较离子浓度大小顺序,运用均摊发计算晶胞.
解答:解:T元素M层上的电子数是原子核外电子层数的2倍,为S元素;
X元素最外层电子数是次外层电子数的2倍,应为C元素;
Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,应为N元素;
Z元素原子最外层电子数是次外层的三倍,应为O元素;
M元素与X、Y、Z既能形成10电子分子又能形成18电子分子,应为H元素,
(1)T元素M层上的电子数是原子核外电子层数的2倍,为S元素,位于元素周期表中第三周期第ⅥA族,即第16枞行,故答案为:3;16;
(2)周期表中,同一周期从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则T、X、Y、Z、M原子半径由大到小的顺序是S>C>N>O>H,故答案为:S>C>N>O>H;
(3)元素Z与M可形成4原子18电子的分子,即H2O2,为共价化合物,电子式为 ,故答案为:
,故答案为: ;
;
(4)Z为O元素,T为S元素,位于同一主族,同一主族中,从上到下元素的非金属性逐渐减弱,则非金属性较强的元素为O,如元素的非金属性越强,则氢化物的稳定性越强,非金属性越强,单质的氧化性越强,可通过单质之间的置换反应证明,单质的聚集状态或氢化物的沸点高低属于物理性质,与非金属性无关,故答案为:O;bd;
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,则该盐为NH4NO3,溶液中NH4+离子水解,溶液呈酸性,则c(NO3-)>c(NH4+),c(H+)>c(OH-),
由于NH4+离子水解程度较弱,则c(NH4+)>c(H+),所以离子的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-),
该盐溶液的pH值为5,则c(H+)=10-5mol/L,溶液中H+离子全部由水电离产生,
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);10-5mol/L;
(6)晶胞中离每一个CO2最近的CO2分子分别是位于顶点和面心的分子,则离每一个CO2最近的CO2分子数位:8×
=12,
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为
晶胞中含有CO2分子的个数为:8×
+6×
=4,则晶胞的质量为:
,晶胞的体积为:a3cm3,
则ρ=
=
(g/cm3)=
(g/cm3),
故答案为:12;
.
X元素最外层电子数是次外层电子数的2倍,应为C元素;
Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,应为N元素;
Z元素原子最外层电子数是次外层的三倍,应为O元素;
M元素与X、Y、Z既能形成10电子分子又能形成18电子分子,应为H元素,
(1)T元素M层上的电子数是原子核外电子层数的2倍,为S元素,位于元素周期表中第三周期第ⅥA族,即第16枞行,故答案为:3;16;
(2)周期表中,同一周期从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则T、X、Y、Z、M原子半径由大到小的顺序是S>C>N>O>H,故答案为:S>C>N>O>H;
(3)元素Z与M可形成4原子18电子的分子,即H2O2,为共价化合物,电子式为
 ,故答案为:
,故答案为: ;
;(4)Z为O元素,T为S元素,位于同一主族,同一主族中,从上到下元素的非金属性逐渐减弱,则非金属性较强的元素为O,如元素的非金属性越强,则氢化物的稳定性越强,非金属性越强,单质的氧化性越强,可通过单质之间的置换反应证明,单质的聚集状态或氢化物的沸点高低属于物理性质,与非金属性无关,故答案为:O;bd;
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,则该盐为NH4NO3,溶液中NH4+离子水解,溶液呈酸性,则c(NO3-)>c(NH4+),c(H+)>c(OH-),
由于NH4+离子水解程度较弱,则c(NH4+)>c(H+),所以离子的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-),
该盐溶液的pH值为5,则c(H+)=10-5mol/L,溶液中H+离子全部由水电离产生,
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);10-5mol/L;
(6)晶胞中离每一个CO2最近的CO2分子分别是位于顶点和面心的分子,则离每一个CO2最近的CO2分子数位:8×
| 3 |
| 2 |
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为
晶胞中含有CO2分子的个数为:8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×M |
| NA |
则ρ=
| m |
| V |
| ||
| a3 |
| 4M |
| a3NA |
故答案为:12;
| 4M |
| a3NA |
点评:本题考查元素推断,题目难度较大,较为综合,注意晶胞的计算为该题的难点,利用均摊法计算.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目






 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-