题目内容
(15分)1mol水蒸汽和炽热的焦炭反应生成水煤气,反应吸热131.4 kJ ·mol-1。利用该反应生成的氢气和空气中的氮气合成氨,其反应的△H<0。氨可以用于制备硝酸。请回答:
(1)生成水煤气的热化学方程式是 ;
(2)合成氨需要在较大的压力下进行的原因是 ;
(3)温度过高或过低对合成氨的影响是 ;
(4)由氨生成HNO3的各步反应的化学方程式是 ;
(5)某化肥厂由NH3制备HNO3,进而生产硝铵(NH4NO3)。假设由氨氧化生成HNO3的总产率是85%,而HNO3和NH3完全反应生成NH4NO3。列式计算:
①从NH3制取NH4NO3过程中,用于中和硝酸所需的氨占总的氨消耗量的分数;
②若氨的消耗总量为100 kg,可生产NH4NO3的量。
(1)生成水煤气的热化学方程式是 ;
(2)合成氨需要在较大的压力下进行的原因是 ;
(3)温度过高或过低对合成氨的影响是 ;
(4)由氨生成HNO3的各步反应的化学方程式是 ;
(5)某化肥厂由NH3制备HNO3,进而生产硝铵(NH4NO3)。假设由氨氧化生成HNO3的总产率是85%,而HNO3和NH3完全反应生成NH4NO3。列式计算:
①从NH3制取NH4NO3过程中,用于中和硝酸所需的氨占总的氨消耗量的分数;
②若氨的消耗总量为100 kg,可生产NH4NO3的量。
(1)C(s)+H2O(g)
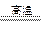 CO(g)+H2(g),△H =" +131.4" kJ ·mol-1
CO(g)+H2(g),△H =" +131.4" kJ ·mol-1(2)合成氨是体积减少的反应,加大压力有利于平衡向生成氨的方向移动
(3)温度过低反应速率慢;合成氨为放热反应,温度过高反应向氨分解的方向进行
(4)4NH3+5NO
 4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO
4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO(5)①中和硝酸所需的氨占总的氨消耗量的分数为
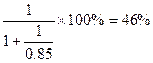
②可生产NH4NO3:100kg×46%×
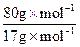 =216kg
=216kg(1)根据题目的叙述和书写热化学方程式的步骤和注意事项,很容易的写出生成水煤气的热化学方程式为C(s)+H2O(g)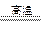 CO(g)+H2(g),△H =" +131.4" kJ ·mol-1,注意焦炭的状态为固体,反应吸热△H应为正值,反应的条件可以不用注明。
CO(g)+H2(g),△H =" +131.4" kJ ·mol-1,注意焦炭的状态为固体,反应吸热△H应为正值,反应的条件可以不用注明。
(2)工业合成氨的化学方程式为N2(g)+3H2(g) 2NH3(g),反应的特点是:正反应为气体体积减小的放热反应。因此根据平衡移动原理,应采用较大的压强,使平衡向生成氨的方向移动。
2NH3(g),反应的特点是:正反应为气体体积减小的放热反应。因此根据平衡移动原理,应采用较大的压强,使平衡向生成氨的方向移动。
(3)在工业上,选择反应条件是既要考虑反应速率,又要考虑反应的产率(即化学平衡);还要考虑催化剂的催化活性问题。因此在合成氨工业中采用的温度为700K,因为在此温度时催化剂——铁触媒的催化活性最高,同时温度过低反应速率太小,温度过高不利于平衡向生成氨的方向移动。
(4)工业制硝酸采用的是氨氧化法,其反应的化学方程式为4NH3+5NO 4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。
4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。
(5)①根据题目要求可知反应的关系为NH3~HNO3、NH3+HNO3=NH4NO3,假设中硝酸所用的氨气的物质的量为1 mol,则中的硝酸为1 mol。根据题目生产硝酸时的总产率为85%,则生产这1 mol硝酸利用了氨的物质的量为 ,所以中和硝酸所需的氨占总的氨消耗量的分数为
,所以中和硝酸所需的氨占总的氨消耗量的分数为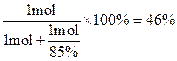 。
。
②根据上一问可知100kg氨中用于中和硝酸的氨有100kg×46%=46kg。则
NH3+HNO3=NH4NO3
17 80
46kg m(NH4NO3)
所以m(NH4NO3)= =216kg。
=216kg。
 CO(g)+H2(g),△H =" +131.4" kJ ·mol-1,注意焦炭的状态为固体,反应吸热△H应为正值,反应的条件可以不用注明。
CO(g)+H2(g),△H =" +131.4" kJ ·mol-1,注意焦炭的状态为固体,反应吸热△H应为正值,反应的条件可以不用注明。(2)工业合成氨的化学方程式为N2(g)+3H2(g)
 2NH3(g),反应的特点是:正反应为气体体积减小的放热反应。因此根据平衡移动原理,应采用较大的压强,使平衡向生成氨的方向移动。
2NH3(g),反应的特点是:正反应为气体体积减小的放热反应。因此根据平衡移动原理,应采用较大的压强,使平衡向生成氨的方向移动。(3)在工业上,选择反应条件是既要考虑反应速率,又要考虑反应的产率(即化学平衡);还要考虑催化剂的催化活性问题。因此在合成氨工业中采用的温度为700K,因为在此温度时催化剂——铁触媒的催化活性最高,同时温度过低反应速率太小,温度过高不利于平衡向生成氨的方向移动。
(4)工业制硝酸采用的是氨氧化法,其反应的化学方程式为4NH3+5NO
 4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。
4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。(5)①根据题目要求可知反应的关系为NH3~HNO3、NH3+HNO3=NH4NO3,假设中硝酸所用的氨气的物质的量为1 mol,则中的硝酸为1 mol。根据题目生产硝酸时的总产率为85%,则生产这1 mol硝酸利用了氨的物质的量为
 ,所以中和硝酸所需的氨占总的氨消耗量的分数为
,所以中和硝酸所需的氨占总的氨消耗量的分数为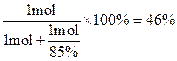 。
。②根据上一问可知100kg氨中用于中和硝酸的氨有100kg×46%=46kg。则
NH3+HNO3=NH4NO3
17 80
46kg m(NH4NO3)
所以m(NH4NO3)=
 =216kg。
=216kg。
练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
 4NO+6H2O,②4NO+3O2+2H2O====4HNO3。设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入100 mL水,得到溶液。
4NO+6H2O,②4NO+3O2+2H2O====4HNO3。设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入100 mL水,得到溶液。