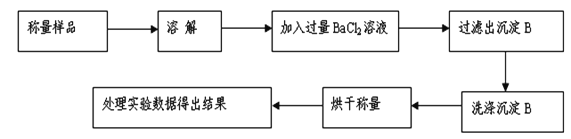
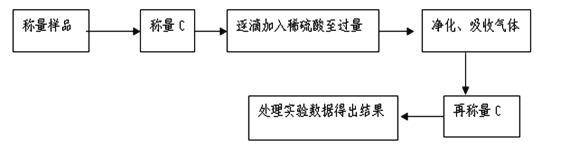
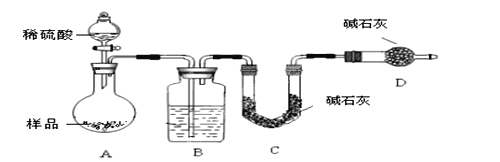
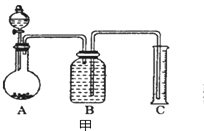
题目内容
【题目】下列各种说法中,正确的是:
A. O2与O3互为同素异形体,但两者之间的转化属于物理变化
B. 设NA为阿伏加德罗常数的值,则6.2g 白磷(P4)含有0.3NA P-P键
C. 足球烯与金刚石互为同分异构体,但二者形成的晶体类型不同
D. 12C与14C的质子数和电子数都为6,故二者是碳元素的同一种核素
【答案】B
【解析】
A.O2与O3是两种不同的单质,互为同素异形体,两者之间的转化属于化学变化,故A错误;
B.6.2g白磷含有P4的物质的量为:![]() =0.05mol,0.05molP4分子中含有P-P键的物质的量为:0.05mol×6=0.3mol,所含P-P键数目为0.3NA,故B正确;
=0.05mol,0.05molP4分子中含有P-P键的物质的量为:0.05mol×6=0.3mol,所含P-P键数目为0.3NA,故B正确;
C. 足球烯与金刚石都是C元素的单质,属于同素异形体,足球烯形成的晶体为分子晶体,金刚石属于原子晶体,故C错误;
D. 12C的质子数和中子数都为6,14C的质子数为6、中子数为8,是碳元素的两种核素,故D错误;
答案选B

 阅读快车系列答案
阅读快车系列答案【题目】研究弱电解质的电离,有重要的实际意义。
Ⅰ. 醋酸是一种常见的有机酸。
(1)醋酸的电离方程式为__________________________________________________。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是________。
A. c(CH3COO-) B. c(H+)
C. c(OH-) D. CH3COOH电离平衡常数
(3)向0.1 mol·L-1 CH3COOH溶液中加水稀释,c(CH3COO-) / c(CH3COOH)的比值将________(填“变大”、“不变”或“变小”)。
(4)下列事实一定能说明CH3COOH是弱电解质的是____________(填字母)。
A. 相同温度下,浓度均为1 mol·L-1的盐酸和醋酸的导电性对比:盐酸>醋酸
B. 1 mol·L-1 CH3COOH溶液能使紫色石蕊试液变红
C. 25℃时,1 mol·L-1 CH3COOH溶液的pH约为2
D. 10 mL 1mol·L-1的CH3COOH溶液恰好与10 mL 1mol·L-1 NaOH溶液完全反应
Ⅱ. 对比酸性的相对强弱
(5)现有a. CH3COOH b. HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
① 将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a_______b。
② pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_______b。
③ 将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a_______b。
④ 相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a_______b。
(6)某些弱酸的电离常数如下:
化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
电 离 常 数 | 1.8×10-5 | 1.3×10-1 | 4.9×10-10 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
①下列反应可以发生的是__________(填字母)。
A. CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
②25℃时,将20 mL 1 mol·L-1 CH3COOH溶液和20 mL 1 mol·L-1 HSCN溶液分别与20 mL1 mol·L-1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式。__________
 。
。