题目内容
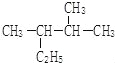
【题目】298K时,在20mLbmol·L-1氧氧化钠溶液中滴入0.10mol·L-1的醋酸,溶液的pH与所加醋酸的体积关系如图所示。下列有关叙述正确的是

A. a<20
B. C点溶液中:c(CH3COO-)+c(CH3C00H)=c(Na+)
C. A、B、C、D四点水的电离程度大小顺序为:D>B>C>A
D. 醋酸的电离平衡常数Ka=2.0×10-7/(0.la-2)
【答案】D
【解析】A. NaOH溶液的pH=13,可知其浓度为0.1mol/L,若a=20mL,则恰好完全反应生成CH3COONa溶液,此时溶液显碱性,现B点溶液显中性,很明显a>20mL,故A错误;B. C点溶液显酸性,溶质为CH3COOH和CH3COONa,根据物料守恒可知c(CH3COO-)+c(CH3COOH)>c(Na+),故B错误;C. A点为强碱性溶液,对水的电离起抑制作用,B点溶液显中性,水正常电离,C、D点溶液显酸性,多余的酸抑制水的电离,滴加的酸越多抑制能力越强,则A、B、C、D四点水的电离程度大小顺序为B>C>D>A,故C错误;D. 在B点溶液pH=7,此时c(H+)=1×10-7mol/L,多余醋酸的物质的量浓度为(0.la-2)/(a+20)mol/L,根据电荷守恒可知溶液中c(CH3COO-)=c(Na+)=2/(a+20)mol/L,则此时醋酸的电离平衡常数Ka=[c(H+)×c(CH3COO-)]/c(CH3COOH)=2.0×10-7/(0.la-2),故D正确;答案为D。

练习册系列答案
相关题目