题目内容
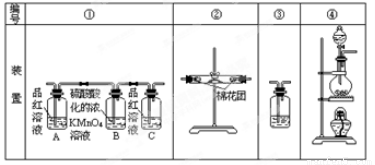
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成 CO2、SO2和H2O。
(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是: 。(2分)
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号) → → → 。(2分)
(3)B瓶溶液的作用是 。(2分)本实验中能说明二氧化硫具有漂白性的实验现象是 。(2分)③中反应的离子方程式为 。(2分)
(4)装置②中所盛是无水硫酸铜,现象是 。(2分)
(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (2)④②①③
CO2↑+2SO2↑+2H2O (2)④②①③
(3)除去SO2;A中品红溶液褪色;CO2+Ca2++2OH-=H2O+CaCO3↓
(4)由白色变为蓝色
【解析】
试题分析:(1)浓硫酸具有强氧化性,在加热的条件下与木炭发生反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(2)浓硫酸与木炭共热化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,生成CO2、SO2和H2O,依次检验CO2、SO2和H2O的存在时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在,即检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳;无水硫酸铜为白色固体,遇水变蓝,可用于检验水;SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的;二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊,所以正确的连接顺序为④②①③。
CO2↑+2SO2↑+2H2O,生成CO2、SO2和H2O,依次检验CO2、SO2和H2O的存在时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在,即检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳;无水硫酸铜为白色固体,遇水变蓝,可用于检验水;SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的;二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊,所以正确的连接顺序为④②①③。
(3)根据以上分析可知B瓶溶液的作用是除去SO2;本实验中能说明二氧化硫具有漂白性的实验现象是A中品红溶液褪色;③中反应的离子方程式为CO2+Ca2++2OH-=H2O+CaCO3↓。
(4)硫酸铜吸水变为胆矾,则装置②中所盛是无水硫酸铜,现象是由白色变为蓝色,
考点:考查浓硫酸与木炭反应产物检验的实验方案设计
