题目内容
20.下列措施能使3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)反应速率增大的是( )①增加铁的用量
②增加水的用量
③用铁粉代替铁屑
④增大体系压强
⑤压强不变,充入N2使容器体积增大.
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
分析 该反应是一个反应前后气体体积不变的反应,增大压强、增大气体浓度、增大反应物接触面积都增大反应速率,据此分析解答.
解答 解:①Fe是固体,铁的多少不影响反应速率,所以增加铁的用量不增大反应速率,故错误;
②增加水的用量,增大水蒸气浓度,则反应速率增大,故正确;
③用铁粉代替铁屑,增大反应物接触面积,增大反应速率,故正确;
④增大体系压强,增大单位体积内活化分子个数,所以反应速率增大,故正确;
⑤压强不变,充入N2使容器体积增大,水蒸气和氢气浓度降低,反应速率减小,故错误;
故选B.
点评 本题考查化学反应速率,为高频考点,明确影响反应速率因素是解本题关键,固体和纯液体不影响反应速率,为易错点.

练习册系列答案
相关题目
10.下列反应类型中一定属于氧化还原反应的是( )
| A. | 生成沉淀的反应 | B. | 有单质参与的反应 | ||
| C. | 歧化反应 | D. | 复分解反应 |
11.下列反应所得溶液中一定只含一种溶质的是( )
| A. | 向AlCl3溶液中滴入NaOH溶液 | |
| B. | 向NaOH溶液中通入SO2气体 | |
| C. | 向浓硝酸中加入过量铜粉 | |
| D. | 向MgCl2、H2SO4的混合液中滴入过量Ba(OH)2溶液 |
8.氮化硅(Si3N4,其中N元素化合价为-3)是一种具有耐高温、熔融态时不导电等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$ Si3N4+6CO.下列说法不正确的是( )
| A. | 上述反应中,Si元素化合价不变 | B. | 氮化硅晶体中含有Si4+ | ||
| C. | Si3N4属于氮化物 | D. | 上述反应属于氧化还原反应 |
15.可逆反应:3X(g)?3Y(?)+Z(?)△H<0,随着温度的降低,气体的平均相对分子质量有变小的趋势,则下列判断正确的是( )
| A. | Y和Z可能都是气体 | B. | Y和Z可能都是固体 | ||
| C. | 若Z为固体,则Y一定是气体 | D. | Y和Z一定是气体 |
5.下列离子方程式中,只能表示一个化学反应的是( )
①CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O
②Fe+Cu2+═Fe2++Cu
③Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O
④Ag++Cl-═AgCl↓
①CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O
②Fe+Cu2+═Fe2++Cu
③Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O
④Ag++Cl-═AgCl↓
| A. | ①③ | B. | ②④ | C. | ②③ | D. | 没有 |
9. 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-570kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则CH4 (g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-865 kJ•mol-1.
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
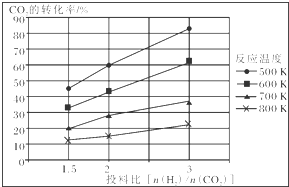
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见如图:
①此反应为放热(填“放热”、“吸热”);若温度不变,提高投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],则K将不变(填“增大”、“减小”或“不变”).
②在a MPa和一定温度下,将6mol H2和2mol CO2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即$\frac{1}{6}$),此时CO2的转化率为80%
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①650℃时该反应的化学平衡常数数值为$\frac{8}{3}$,该反应的逆反应为放(填“吸”或“放”)热反应
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是b=2a,a>1(用含a、b的数学式表示).
 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-570kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则CH4 (g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-865 kJ•mol-1.
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见如图:
①此反应为放热(填“放热”、“吸热”);若温度不变,提高投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],则K将不变(填“增大”、“减小”或“不变”).
②在a MPa和一定温度下,将6mol H2和2mol CO2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即$\frac{1}{6}$),此时CO2的转化率为80%
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是b=2a,a>1(用含a、b的数学式表示).
10.维生素通常根据他们的溶解度来进行分类,它们或者溶解在水中或者溶解在脂肪中.下列维生素中属于水溶性维生素的是( )
| A. | 维生素A | B. | 维生素C族 | C. | 维生素D | D. | 维生素E |