题目内容
已知某溶液中只存在OH-、Cl-、NH4+、H+四种离子,下列说法不正确的是( )
| A、若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性 |
| B、若溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3?H2O |
| C、若溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl |
| D、若溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A.溶液中存在电荷守恒,根据电荷守恒判断c(OH-)、c(H+)相对大小,从而确定溶液酸碱性;
B.氯化铵溶液呈酸性,如果溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),溶液中的溶质为NH4Cl和NH3?H2O;
C.氯化铵溶液呈酸性,若溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl;
D.若溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-),则溶液中存在大量的HCl和少量的NH4Cl.
B.氯化铵溶液呈酸性,如果溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),溶液中的溶质为NH4Cl和NH3?H2O;
C.氯化铵溶液呈酸性,若溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl;
D.若溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-),则溶液中存在大量的HCl和少量的NH4Cl.
解答:
解:A.溶液中存在电荷守恒,若溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH-)=c(H+),则溶液呈中性,故A正确;
B.如果溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),氯化铵溶液呈酸性,要使混合溶液呈碱性,则氨水过量,所以溶液中的溶质为NH4Cl和NH3?H2O,故B正确;
C.若溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),溶液呈酸性,氯化铵溶液呈酸性,要使溶液呈酸性,氨水和HCl可能恰好反应也可能HCl过量,所以溶液中可能含有NH4Cl或可能含有NH4Cl和HCl,故C正确;
D.若溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-),溶液中c(H+)>c(NH4+)且溶液呈酸性,则溶液中存在大量的HCl和少量的NH4Cl,故D错误;
故选D.
B.如果溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),氯化铵溶液呈酸性,要使混合溶液呈碱性,则氨水过量,所以溶液中的溶质为NH4Cl和NH3?H2O,故B正确;
C.若溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),溶液呈酸性,氯化铵溶液呈酸性,要使溶液呈酸性,氨水和HCl可能恰好反应也可能HCl过量,所以溶液中可能含有NH4Cl或可能含有NH4Cl和HCl,故C正确;
D.若溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-),溶液中c(H+)>c(NH4+)且溶液呈酸性,则溶液中存在大量的HCl和少量的NH4Cl,故D错误;
故选D.
点评:本题考查了离子浓度大小比较,根据离子浓度关系再结合物质的性质确定溶液中的溶质,明确电解质特点是解本题关键,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”.根据等电子原理,下列各组粒子结构不相似的是( )
| A、BCl3和PH3 |
| B、NH4+和CH4 |
| C、NO3-和CO32- |
| D、CO2和N2O |
下列表述正确的是( )
| A、醛基的结构简式-COH |
B、聚丙烯的结构简式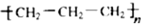 |
C、四氯化碳分子的电子式 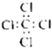 |
D、丙烷分子的球棍模型 |
Al、Fe、Cu都是重要的金属元素,下列说法正确的是( )
| A、三者对应的氧化物均为碱性氧化物 |
| B、三者的单质放置在空气中均只生成氧化物 |
| C、Fe2O3与Fe3O4互为同素异形体 |
| D、常温下三者加入浓硫酸中均无明显现象 |
下列表示物质结构的化学用语或说法中,正确的是( )
A、8个中子的碳原子的核素符号:
| ||
B、HF的电子式: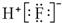 | ||
C、次氯酸的电子式: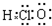 | ||
| D、CCl4分子的每个原子都满足8电子稳定结构 |
下列反应中HNO3既表现出酸性又表现出强氧化性的是( )
| A、稀硝酸与Fe2O3反应 |
| B、稀硝酸与NaOH溶液反应 |
| C、浓硝酸与灼热的碳反应 |
| D、浓硝酸与铜反应 |
NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、78g Na2O2固体中含有的阴阳离子总数为3NA |
| B、1mol?L-1 NaOH溶液中含有NA个Na+ |
| C、标准状况下,2.24L CCl4中含有的C-Cl键的数目为0.4NA |
| D、常温常压下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA |